Hidroksīdi ir kodīgas un bīstamas vielas, kas sastāv no metāla jona un vienas vai vairākām grupām (hidroksilgrupām). Šķīstošus hidroksīdus sauc par bāzēm. Hidroksīdu šķīdību nosaka skābju, bāzu un sāļu šķīdības tabulā.
Hidroksīdu formulas veido atbilstoši metāla un hidroksilgrupas oksidācijas pakāpēm.
Hidroksīduformulu veidošana
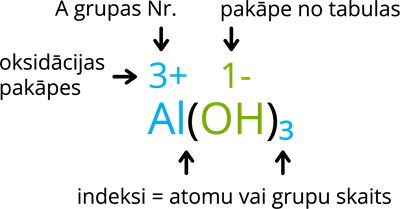
1. darbība: uzraksti oksidācijas pakāpes virs metāla jona un hidroksilgrupas. Pozitīvā metāla oksidācijas pakāpe sakrīt ar A grupas numuru (A grupas elementiem, B grupas elementiem vari to nolasīt no sāļu, skābju un hidroksīdu šķīdības tabulas), hidroksilgrupai oksidācijas pakāpi nosaki pēc sāļu, skābju un hidroksīdu šķīdības tabulas (tā vienmēr būs 1-).
2. darbība: indeksus izvieto tāpat kā binārajā savienojumā (savienojums, kas sastāv no 2 dažādiem elementiem): metāla oksidācijas pakāpi bez "+" zīmes raksti aiz hidroksilgrupas, bet hidroksilgrupas oksidācijas pakāpi bez "-" zīmes raksti pie metāla. Ja aiz hidroksilgrupas ir jāievieto indekss, kas lielāks par 1, hidroksilgrupu liec iekavās. Ja oksidācijas pakāpe ir 1+ vai 1-, tad indeksu 1 vari nerakstīt.
Piemērs:
Nātrija (Na) oksidācijas pakāpe ir 1+ jeb . Hidroksilgrupas oksidācijas pakāpe vienmēr ir 1- jeb . Ievērojot formulas veidošanas principus, varam secināt, ka izveidojas formula , ar nosaukumu nātrija hidroksīds.
Piemērs:
Magnija (Mg) oksidācijas pakāpe ir 2+ jeb . Hidroksilgrupas oksidācijas pakāpe vienmēr ir 1- jeb . Ievērojot formulas veidošanas principus, varam secināt, ka izveidojas formula, ar nosaukumu magnija hidroksīds.
Svarīgi!
Ievēro - ja metālam oksidācijas pakāpe ir lielāka par 1+, tad hidroksilgrupu liek iekavās, aiz kuras norāda hidroksilgrupu skaitu, atbilstoši metāla oksidācijas pakāpei. Tas norāda to, ka indekss aiz hidroksilgrupas attiecas uz visu grupu - gan ūdeņraža, gan skābekļa atomiem (apskati magnija hidroskīda piemēru).
Hidroksīdu nosaukumu veidošana: vispirms nosauc metālu, kas veido hidroksīdu un tam pievieno vārdu "hidroksīds". Piemēram, litija hidroksīds () , alumīnija hidroksīds (), bārija hidroksīds ().
Hidroksīdus iegūst aktīvo metālu oksīdu reakcijās ar ūdeni.
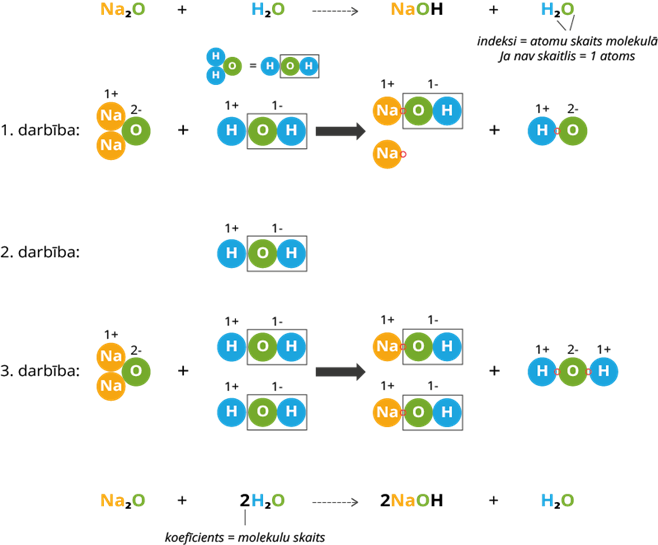
1. darbība: metāls sagrupējas ar grupu, kas nāk no ūdens molekulas. Atceramies, ka oksidācijas pakāpe norāda elektronu skaitu, kuru elements vai atomu grupa spēj atdot vai pievienot (shēmā norādīti ar sarkaniem riņķiem). Atdoto un pievienoto elektronu skaits starp elementiem un grupām sakrīt. Viens var atdot vienu elektronu vienai grupai. Kā redzam, paliek pāri viens jons un grupa, kas veidojās no ūdens ūdeņraža jona un nātrija oksīda skābekļa atoma.
2. darbība: pievienojam vienu ūdens molekulu, lai ievērotu vielas un masas nezūdamības likumu. Ūdens grupa pievienosies jonam produktos, bet ūdeņraža jons pievienosies brīvajai grupai, veidojot ūdens molekulu.
3. darbība: ar molekulu modeļu palīdzību redzam, ka atomu skaits izejvielās un produktos šobrīd sakrīt. Rekacija ir pabeigta. Saskaita molekulu skaitu izejvielās un produktos, pieraksta koeficientus reakcijas vienādojumā.
Svarīgi!
Reakcijas shēma ar molekulu modeli ir domāta izpratnes veidošanai. Tā nav obligāti jāraksta, darbības var veikt galvā.
Piemērs:
Ļoti aktīvi metāli, piemēram, litijs (Li) un nātrijs (Na), un kālijs (K) arī var reaģēt ar ūdeni un veidot produktā hidroksīdu un ūdeņraža gāzi.
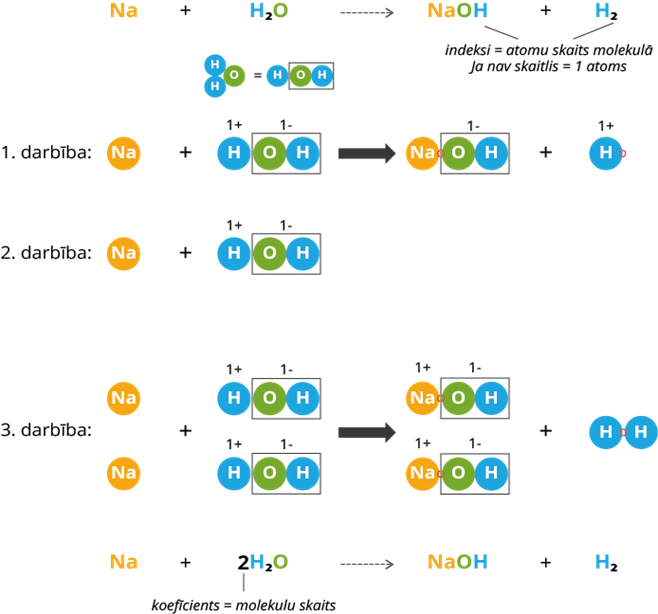
1. darbība: produktos jons savienojas ar ūdens grupu. Kā redzam, paliek brīvs ūdeņraža atoms. Tā kā brīvs ūdeņraža atoms nemēdz eksistēt, tad ir nepieciešams vēl otrs ūdeņraža atoms.
2. darbība: izejvielās pievieno vēl vienu ūdens molekulu, lai iegūtu ūdeņraža atomu. Klāt pievieno arī vienu Na atomu, kas vēlāk savienosies ar ūdens brīvo grupu.
3. darbība: ar molekulu modeļiem pabeidz reakcijas vienādojumu un redz, ka izejvielās un produktos sakrīt atomu skaits. Reakcija ir pabeigta. Saskaita molekulu skaitu izejvielās un produktos, reakcijas vienādojumā ieraksta koeficientus.
Hidroksīdu izmantošana
Hidroksīdi ir sastopami gan dabā minerālu veidā, gan arī plaši tiek izmantoti saimniecībā un rūpniecībā. Ikdienā plaši tiek izmantots nātrija un kālija hidroksīdi ziepju un citu bāzisko mazgājamo līdzekļu ražošanā.