PIRMĀ SEMESTRA NOSLĒGUMA TESTI
Sāļi ir vielas, kas sastāv no metāla jona un skābes atlikuma. Sāļus var iegūt skābju un bāzu (šķīstošu hidroksīdu) reakcijās.
Sāls formulas izveidošana
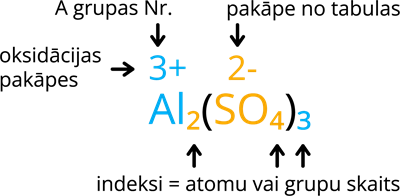
1. darbība: uzraksti oksidācijas pakāpes virs elementiem un skābes atlikuma grupas. Pozitīvā metāla oksidācijas pakāpe sakrīt ar A grupas numuru (A grupas elementiem, B grupas elementiem vari to nolasīt no sāļu, skābju un hidroksīdu šķīdības tabulas), skābes atlikumam oksidācijas pakāpi nosaki pēc sāļu, skābju un hidroksīdu šķīdības tabulas.
2. darbība: indeksus izvieto tāpat kā binārajā savienojumā (savienojums, kas sastāv no 2 dažādiem elementiem): metāla oksidācijas pakāpi bez "+" zīmes raksti aiz skābes atlikuma, bet skābes atlikuma oksidācijas pakāpi bez "-" zīmes raksti pie metāla. Ja aiz skābes atlikuma, kas sastāv vismaz no 2 dažādiem elementiem, ir jāievieto indekss, kas lielāks par 1, skābes atlikumu liec iekavās. Ja oksidācijas pakāpes ir 1+ vai 1-, tad indeksu 1 vari nerakstīt.
Neitralizācijas reakcija ir reakcija, kurā reaģē skābe un šķīstošs hidroksīds jeb bāze. Produktos veidojas sāls un ūdens - divas neitrālas vielas.
Neitralizācijas reakcijas shēma:
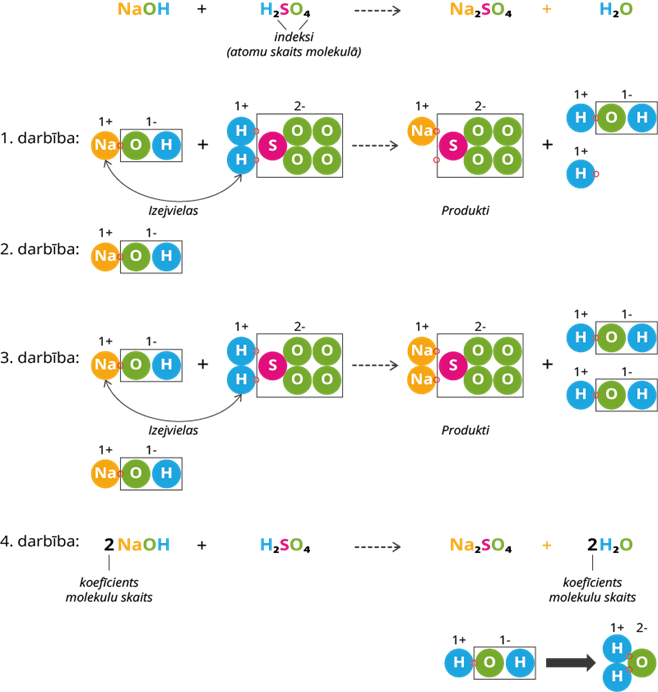
1. darbība: izejvielās ir šķīstošs hidroksīds, kas sastāv no nātrija jona un hidroksilgrupas, kā arī skābe, kas sastāv no pozitīva ūdeņraža jona un negatīvi lādēta skābes atlikuma. Kā redzam shēmā - notiek apmaiņas reakcija - nātrija jons savienojas ar skābes atlikumu, bet ūdeņraža jons pievienojas hidroksilgrupai. Atceramies, ka ir jāievēro oksidācijas pakāpju likums - nātrija jons spēj atdot tikai vienu elektronu, kamēr skābes atlikums dotajā gadījumā spēj pievienot divus elektronus (skābes atlikumiem oksidācijas pakāpi nosaki pēc skābju, bāzu un sāļu šķīdības tabulas). Kā redzam, tad skābes atlikumam trūkst vēl viens nātrija jons, kā arī brīvs ir viens ūdeņraža jons.
2. darbība: pievienojam vienu nātrija hidroksīda molekulu, lai nodrošinātu trūkstošos jonus produktos.
3. darbība: nātrija jons pievienojas skābes atlikumam, bet brīvo hidroksilgrupu pievieno produktos esošais ūdeņraža jons. Kā redzam shēmā, tad visi joni ir savienojušies un ir ievērots masas un vielas nezūdamības likums.
4. darbība: saskaita molekulu skaitu izejvielās un produktos, pieraksta reakcijā koeficientus.
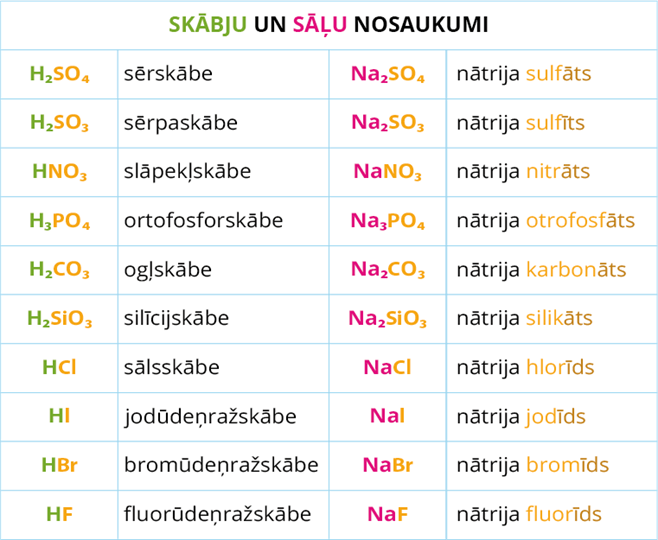
Sāļu nosaukumus veido atbilstoši skābes atlikumam, kuru satur sāls. Sāļa nosaukumu sāk nosaukt ar metālu, kas veido sāli, tālāk nosaucot skābes atlikumu (skatīt tabulā ).
Svarīgi!
Lai apgūtu skābju un sāļu nosaukumus, biežāk lietotie skābju un sāļu nosaukumi ir jāiemācās no galvas.