Savienošanās reakcijas ir vienas no vienkāršākajām ķīmiskajām reakcijām, kurās no divām vai vairākām izejvielām (vienkāršām vielām) veidojas viens produkts (salikta viela). Vispārīgā veidā to var pierakstīt sekojoši: A + B —>AB, kur ar A un B ir apzīmēti ķīmiskie elementi.
Savienošanās reakcijas risinājums ar shēmu:
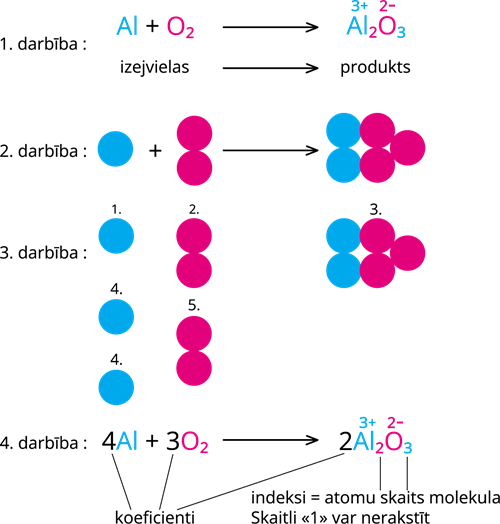
1. darbība: Reakcijā uzraksta izejvielas un produktus. Rakstot produktu, vispirms jāsaraksta oksidācijas pakāpes, bet pēc tam indeksi: 1. elementa oksidācijas pakāpi bez "+" zīmes raksta pie otrā elementa lejā, bet otrā elementa oksidācijas pakāpi bez "- " zīmes, raksta pie pirmā elementa lejā.
2. darbība (darbību veic galvā, bet sākotnēji var arī zīmēt, ja tā ir ērtāk): izejvielas attēlo kā molekulu modeļus. Alumīnijs sastāv no viena atoma, bet skābekļa molekula no diviem atomiem. Ar molekula modeli attēlo arī alumīnija oksīdu- divi alumīnija atomi un 3 skābekļa atomi.
3. darbība: lai tiktu ievērots masas un vielas nezūdamības likums, atomu skaitam un veidam ir jāsakrīt izejvielās un produktos. Redzam, ka izejvielās ir 1 alumīnija atoms, bet produktos 2 alumīnija atomi, tāpēc izejvielās pievieno otru alumīnija atomu (1.). Redzam, ka nesakrīt arī skābekļa atomu skaits: izejvielās ir 2 skābekļa atomi, bet produktos 3 skābekļa atomi. Tā kā skābekļa molekulai izejvielās nevar pievienot trešo atomu - tad tā vairs nebūs viela skābeklis, tad ir jāpievieno vēl viena skābekļa molekula (2.). Šobrīd redzam, ka atkal skābekļa atomu skaits nesakrīt izejvielās un produktos - produktos pievienojam vēl vienu alumīnija oksīda molekulu (3.). Šobrīd redzam, ka izejvielās ir nepieciešami vēl divi alumīnija atomi (4.) un vēl viena skābekļa molekula (5.). Saskaitot atomu skaitu izejvielās un produktos redzam, ka atomu skaits sakrīt. Reakcija ir pabeigta.
4. darbība: saskaita katra veida molekulu skaitu un pieraksta vielu priekšā koeficientus: 4 alumīnija vienatoma molekulas reaģē ar 3 divatomu skābekļa molekulām un veidojas 2 alumīnija oksīda molekulas, kas sastāv no 2 alumīnija un 3 skābekļa atomiem.
Svarīgi!
Ja risini reakcijas vienādojumu ar shēmas palīdzību, tad gan izejvielās, gan produktos nevari mainīt molekulu sastāvu. Ja nepieciešams kāds atoms, ir jāpalielina jau esošo molekulu skaits.
Savienošanās reakcijas vienādošana ar matemātisko metodi:
1. Uzraksti dotās reakcijas izejvielas un produktus. Produktu sastādi pareizi - lietojot oksidācijas pakāpes un indeksus tā, kā to iemācījies darīt, rakstot bināros savienojumus.
2. Redzam, ka produktā pie alumīnija ir indekss 2, secinām, ka produktā ir 2 alumīnija atomi. Arī izejvielās ir nepieciešami 2 alumīnija atomi. Molekulas sastāvu mainīt nevar, tāpēc mainām molekulu skaitu - pie alumīnija izejvielās pievienojam koeficientu 2.
3. Redzam, ka produktā pie skābekļa ir indekss 3, secinām, ka produktā ir 3 skābekļa atomi. Izejvielās un produktos ir nepieciešams vienāds atomu skaits. Tā kā izejvielās ir pāra skābekļa atomu skaits (2 atomi), bet produktos ir nepāra skābekļa atomu skaits ( 3 atomi), tad izdomājam kopējo mazāko dalāmo, kas dalās gan ar skaitli 2, gan skaitli 3. Secinām, ka tas ir skaitlis 6. Lai izejvielās būtu 6 skābekļa atomi, nepieciešamas 3 skābekļa molekulas (6 : 2 = 3), bet produktos ir nepieciešamas divas alumīnija oksīda molekulas (6 : 3 = 2). Izvieto koeficientus molekulu priekšā.
4. Redzam, ka nomainoties alumīnija oksīdu molekulu skaitam produktos, mainās arī alumīnija atomu skaits produktos - divās alumīnija oksīda molekulās ir 4 alumīnija atomi (2 * 2 = 4). Arī izejvielās ir nepieciešami 4 alumīnija atomi. Nosvītro koeficientu 2 alumīnija priekšā un pārlabo to uz koeficientu 4.
5. Veicam pārbaudi, vai sakrīt atomu skaits izejvielās un produktos.
4 alumīnija atomi izejvielās un 2 * 2 = 4 alumīnija atomi produktos (atomu skaitu vienā molekulā reizina ar molekulu skaitu)
3 * 2 = 6 skābekļa atomi izejvielās un 2 * 3 = 6 skābekļa atomi produktos.
6. Secinām, ka atomu skaits izejvielās un produktos sakrīt gan pēc veida, gan skaita - ir ievērots masas un vielas nezūdamības likums.
Svarīgi!
Reakcijas vienādošanas darbību skaits ir atšķirīgs. Ir garākas reakcijas, kurās ir nepieciešamas vairāk darbības, lai atomu skaits sakristu izejvielās un produktos, bet ir reakcijas, kurās darbību skaits ir mazāks.
Piemērs:
Litija reakcijā ar vielu hlors (divatomu molekula) ir nepieciešamas divas darbības, lai reakcija tiktu novienādota (katra darbība NAV jāraksta atsevišķi - koeficientus var izvietot jau sākotnēji uzrakstītajā piemērā. Paraugā ir uzrakstīta domāšanas gaita).
Magnija reakcijā ar hloru atomu skaits sakrīt izejvielās un produktos uzreiz pēc pareiza produkta izveidošanas.
Savienošanās reakcija ir shematisks pieraksts ķīmiskām pārvērtībām, kurās no divām vai vairākām vienkāršām vielām veidojas viena salikta viela.