Sadalīšanās reakcijas ir ķīmiskas pārvērtības, kurā no vienas saliktas vielas veidojas divas vai vairākas vielas. Vispārīgā veidā sadalīšanās reakciju var uzrakstīt sekojoši: AB —> A + B, kur A un B ir ķīmiskie elementi.
Sadalīšanās reakcijas shēma:
Risinot vienādojumus nav obligāti jāzīmē molekulu modeļi, taču tie sākumā palīdz izprast reakcijā notiekošos procesus. Darbības var veikt galvā.
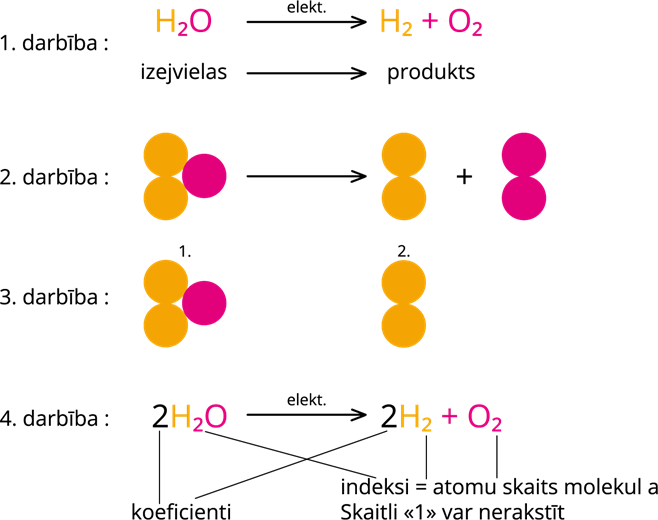
1. darbība: reakcijā uzraksta izejvielu un produktus. Sadalīšanās reakcijas produkti saturēs tādus pašus ķīmiskos elementus, kādi ir izejvielā. Pamatskolas kursā nav daudz sadalīšanās reakciju, tāpēc produktus visbiežāk apgūst tad, kad mācās konkrēto ķīmisko pārvērtību. Dotajā paraugā ir attēlota ūdens molekulas sadalīšana ar elektriskās strāvas palīdzību.
2. darbība: izejvielas un produktus var uzzīmēt ar molekulu modeļiem. Zīmēt molekulu modeļus nav obligāti, taču sākotnēji tas palīdz izprast reakcijas būtību.
3. darbība: saskaita atomu skaitu izejvielās un produktos. 2. darbībā var redzēt, ka izejvielās un produktos ir divi ūdeņraža atomi - atomu skaits sakrīt, taču izejvielās ir viens skābekļa atoms, bet produktos ir divi skābekļa atomi. Lai novienādotu atomu skaitu izejvielās pievieno vēl vienu ūdens molekulu. Pēc ūdens molekulas pievienošanas var redzēt, ka skābekļa atomu skaits sakrīt izejvielās un produktos, bet ir nepieciešams produktos pievienot vēl vienu ūdeņraža (divatomu molekulu - viela ūdeņradis) molekulu. Pārbaudām, ka atomu skaits izejvielās un produktos sakrīt.
4. darbība: saskaita molekulu skaitu un pieraksta koeficientus ķīmiskajā reakcijā. Sadalot divas ūdens molekulas veidojas 2 ūdeņraža molekulas un viena skābekļa molekula.
Svarīgi!
Ja risini reakcijas vienādojumu ar shēmas palīdzību, tad gan izejvielās, gan produktos nevari mainīt molekulu sastāvu. Ja nepieciešams kāds atoms, ir jāpalielina jau esošo molekulu skaits.
Sadalīšanās reakcijas vienādošana ar matemātisko metodi:
1. Uzraksti reakcijas vienādojuma izejvielas un produktus. Gan izejvielas, gan produktus sastādi pareizi, lietojot oksidācijas pakāpes un pareizas vielu formulas.
bultiņas uz augšu norāda to, ka vielas ir gāzes. Ūdeņraža gāze un viela skābeklis ir divatomu molekulas - katra sastāv no diviem vienādiem atomiem.
2. Indekss pie ūdeņraža atoma izejvielās norāda, ka ūdens molekulā ir 2 ūdeņraža atomi. Tāpat redzam, ka produktā ūdeņraža gāzes molekula sastāv no diviem ūdeņraža atomiem. Ūdeņraža atomu skaits izejvielās un produktos sakrīt. Ūdens molekulā ir 1 skābekļa atoms, bet produktos viela skābeklis sastāv no diviem atomiem. Tāpēc izejvielās trūkst viens skābekļa atoms. Lai izlīdzinātu atomu skaitu, izejvielās ir nepieciešamas divas ūdens molekulas - pie ūdens molekulas liek koeficientu 2.
3. Mainot ūdens molekulu skaitu redzam, ka mainās arī ūdeņraža atomu skaits. Divās ūdens molekulās ir 2 ūdeņraža atomi (vienā molekulā ir 2 atomi, 2 molekulās ir 4 ūdeņraža atomi). Produktā šobrīd trūkst 2 ūdeņraža atomi. ir nepieciešams palielināt ūdeņraža gāzes molekulu skaitu līdz 2 molekulām, lai izlīdzinātu atomu skaitu izejvielās un produktos.
4. Veic pārbaudi un saskaita atomu skaitu izejvielās un produktos.
Divās ūdens molekulās ir 4 ūdeņraža atomi (2 * 2 = 4) un 2 skābekļa atomi (2 * 1 = 2). Produktos 2 ūdeņraža gāzes molekulās ir 4 ūdeņraža atomi (2 *2 = 4), bet vienā skābekļa molekulā ir 2 atomi. Atomu skaits izejvielās un produktos sakrīt. Sadalīšanās reakcija ir pabeigta. Atceries, ka tev nav jāraksta katra darbība jaunā rindiņā.
Reakcijas vienādošanas darbību skaits ir atšķirīgs. Ir garākas reakcijas, kurās ir nepieciešamas vairāk darbības, lai atomu skaits sakristu izejvielās un produktos, bet ir reakcijas, kurās darbību skaits ir mazāks.
Piemērs:
Turpinot mācīties ķīmiju, apgūsi tādas vielas kā skābes. Ogļskābe ir viela, kas parasti sadalās līdz divām vielām. Uzrakstot pareizi izejvielu un produktu molekulformulas redzam, ka atomu skaits izejvielās un produktos sakrīt bez papildus koeficientu pievienošanas.
Alumīnija oksīds ir viela, kuru var sadalīt karsējot. Kā redzam, tad izejvielās un produktos nesakrīt atomu skaits. Skābekļa atomu skaits izejvielās ir nepāra skaitlis, tāpēc meklējam kopējo dalāmo, kas dalās ar 3 un 2 (skābekļa atomu skaitu izejvielās un produktos), secinām, ka tas ir 6. Izejvielās ir nepieciešamas 2 alumīnija oksīda molekulas (6 : 3 = 2), bet produktos ir nepieciešamas 3 skābekļa molekulas (6 : 2 = 3). Mainot alumīnija oksīda molekulu skaitu redzam, ka izejvielās ir 4 alumīnija atomi ( 2 * 2 = 4), tāpēc produktos pievienojam koeficientu 4 pirms alumīnija.
Svarīgi!
Visas darbības var veikt galvā, sākotnējā reakcijā pierakstot tikai koeficientus. Reakcijas vienādojums nav jāpārraksta vairākas reizes, paraugā katra darbība ir uzrakstīt atsevišķi, lai būtu izprotama domāšanas shēma.