Elektrolīze
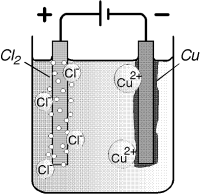
Elektrolīze ir oksidēšanās – reducēšanās process, kurš notiek uz elektrodiem, ja caur elektrolīta šķīdumu vai kausējumu no ārējā strāvas avota plūst līdzstrāva. Pieslēdzot šķīdumā vai kausējumā iegremdētiem elektrodiem līdzstrāvas avotu, elektrolīta pozitīvie joni sāk kustēties uz katodu, pie kura tie saņem elektronus un reducējas, savukārt negatīvie joni virzās uz anodu, pie kura tie atdod elektronus un oksidējas.
Elektrolīzei ir liela praktiskā nozīme metālu iegūšanā, to attīrīšanā no piemaisījumiem, metāla pārklājumu veidošanā (hromēšana, niķelēšana) un citur. Elektrolizēt var gan elektrolītu šķīdumus, gan to kausējumus. Abos gadījumos elektriskās strāvas pārnesēji ir joni. Elektrolītu kausējumos atrodas tikai tie joni, kas rodas, disociējot pašam elektrolītam, bet šķīdumos jāņem vērā arī ūdens jonu klātbūtne, tādēļ elektrolīzes procesi kausējumos ir vienkāršāki.
Izdalītās vielas daudzuma aprēķins elektrolīzes procesos
Angļu fiziķis Maikls Faradejs, deviņpadsmitā gadsimta trīsdesmitajos gados pētīdams elektrolīzes procesus, konstatēja, šādas likumības. Vielu masa, kas izdalās elektrolīzes procesā, ir proporcionāla caur elektrolītu izplūdušajam elektrības daudzumam. Vienādi elektrības daudzumi dažādu elektrolītu šķīdumu elektrolīzē izdala ekvivalentus vielas daudzumus.
Mūsu dienās tos saucam par Faradeja likumiem.
kur:
m – elektrodā izdalītās vielas masa,g;
M – vielas molmasa, g/mol:
I - strāva, A;
t – laiks, s;
z - elektronu skaits, kas piedalās redoksprocesā;
F - Faradeja konstante, 96500 C;
Atsauce:
http://www.vispariga-kimija.lv/home/satura-raditajs