Kausējumu elektrolīze
Kausējumu elektrolīzes izmantošana praksē rada grūtības, jo tā ir saistīta ar ļoti augstām temperatūrām, elektrolīzē iegūtais metāls var sākt šķīst izkausētajā elektrolītā.
Kausējumu elektrolīzi galvenokārt izmanto rūpnieciskai sārmu un sārmzemju metālu, alumīnija un halogēnu iegūšanai.
Tipisks praksē izmantots kausējuma elektrolīzes piemērs ir nātrija hlorīda kausējuma elektrolīze, kurā vienlaicīgi tiek iegūts nātrijs un hlors (attēlā).
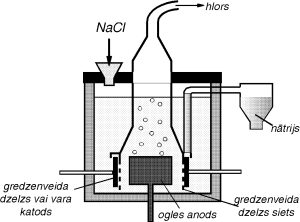
NaCl elektrolīzē pie katoda reducējas nātrija joni, veidojoties nātrijam, bet pie anoda oksidējas hlorīdjoni un izdalās hlors:
Summārais vienādojums:
Ar F elektrolīzes vienādojumos apzīmē Faradeja konstanti - 96500 kulonus lielu caurplūdušās elektrības daudzumu.
Atsauce:
http://www.vispariga-kimija.lv/home/satura-raditajs