Visu metālu iegūšanas paņēmienu pamatā ir reducēšanas process, ko vispārīgā veidā var attēlot šādi:
Vidēji aktīvos metālus reducē no to oksīdiem ar ogli vai oglekļa(II) oksīdu, ar alumīniju vai ūdeņradi.
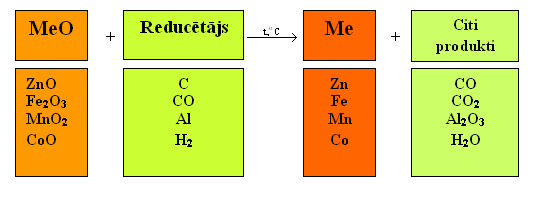
Attiecīgās reakcijas:
Svarīgi!
Visbiežāk praksē, lai iegūtu tīrus metālus no metālu oksīdiem, izmanto reducēšanu ar oglekli.
Aktīvos metālus (I A un II A grupas metāli, Al) var iegūt, tikai elektrolizējot to savienojumu kausējumus.
Elektrolīze ir oksidēšanas-reducēšanas process, kas noris pie elektrodiem, ja caur elektrolīta šķīdumu vai kausējumu plūst līdzstrāva. Elektrolīzes procesā katjoni virzās uz katodu, bet anjoni – uz anodu. Sasnieguši elektrodus, joni izlādējas. Pie anoda notiek elektronu atdošana jeb oksidēšanās, bet pie katoda – elektronu pievienošana jeb reducēšanās.
Elektrolīze tiks aplūkota vidusskolas tēmās!
Dzelzs iegūšana
Ķīmiski tīru dzelzi iegūst vai nu dzelzs sāļu ūdens šķīdumu elektrolīzes procesā, vai termiski sadalot dzelzs pentakarbonilu.
Rūpniecībā dzelzi iegūst galvenokārt dažādu dzelzs un oglekļa sakausējumu — čuguna un tērauda veidā, reducējot bagātināto dzelzsrūdu dzelzs oksīdus ar koksa oglekli, resp., ar oglekļa oksīdu vai metānu:
Alumīnija iegūšana
Alumīniju iegūst no boksīta rūdas, šī rūda satur alumīnija oksīdu, kas tālāk tiek reducēts līdz tīram alumīnijam.
Svarīgi!
Metālu iegūšana no rūdām ir dārga, jo lielākā daļa bagāto rūdu (metālu rūdas, kas satur augstu metāla saturu minerālā) ir gandrīz izsīkušas, tāpēc ievērojami palielinās izmaksas, lai no mazāk bagātām rūdām iegūtu metālus. Šo problēmu cenšas risināt, nevis iegūstot metālu no rūdas, bet pārstrādājot jau esošo metālu.
Atsauce:
http://www.dzm.lu.lv/kim/IT/K_11/default.aspx@tabid=21&id=140.html