pH jēdziens un pH vērtības noteikšana
Ūdeņraža joni nosaka vielu skābās īpašības, bet hidroksīdjoni - bāziskās īpašības.
Ja vidē ūdeņraža jonu un hidroksīdjonu koncentrācija ir vienāda, tad šādu vidi sauc par neitrālu.
Tīrā ūdenī ūdeņraža jonu un hidroksīdjonu koncentrācijas ir vienādas.
Izmērot elektrovadītspēju, ir aprēķināta ūdeņraža jonu un hidroksīdjonu koncentrācija tīrā ūdenī + temperatūrā.
Lai aprēķinos nebūtu jālieto neparocīgi mazi skaitļi, izmanto logaritma definīciju un izsaka ūdeņraža jonu koncentrāciju.
Ūdeņraža eksponentu, kuru apzīmē ar pH, definē kā negatīvo logaritmu no ūdeņraža (hidroksonija) jonu koncentrācijas.
Visiem ūdens šķīdumiem temperatūrā pH + pOH = 14.
Nav iespējams brīvi mainīt tikai vienu jonu ( vai ) koncentrāciju. Mainoties vienam no šiem lielumiem, otrs mainīsies tā, lai summa paliktu nemainīga.

Izmantojot šo sakarību, var spriest par šķīduma skābajām un bāziskajām īpašībām. Raksturojot šķīduma reakciju, parasti norāda tikai pH vērtību, jo pOH var viegli aprēķināt:
pOH = 14 - pH
Arī pēc tam, kad ūdenī izšķīdušas dažādas vielas, šķīdums ir neitrāls, ja abu šo jonu koncentrācija ir vienāda.
Neitrālos ūdens šķīdumos .
Ūdeņraža un hidroksīdjonu koncentrācija nav vienāda, ja ūdenī izšķīdina skābi vai bāzi. Tad šāds šķīdums ir kļuvis skābs vai bāzisks. Skābei disociējot ūdenī, tajā papildus tiek ievadīti ūdeņraža joni. Hidroksīdjonus var ievadīt ūdenī, šķīdinot sārmu un sārmzemju metālu hidroksīdus.
Gan cilvēku, gan dzīvnieku organismos, gan arī apkārtējā vidē noris daudzas reakcijas, kurās rodas vai tiek patērēti ūdeņraža joni vai hidroksīdjoni.
Augsnes šķīduma pH vērtības noteikšana un nodrošināšana ir viens no svarīgākajiem priekšnoteikumiem, lai varētu iegūt augstas kultūraugu ražas. Lai augi labi augtu, augsnes šķīduma pH vērtībai jābūt noteiktās robežās.
pH mērīšana
Dažādu šķīdumu skābuma vai bāziskuma raksturošanai un salīdzināšanai izmanto pH skalu, kura parasti ir robežās no 0 līdz 14.
Ūdens šķīdumu vides pH vērtību kontrolēšanai lieto indikatorus - organiskas vielas, kas maina savu krāsu atkarībā no šķīduma pH vērtības. Indikatoru krāsas maiņas intervāli atrodami ķīmijas rokasgrāmatās.

Ja prasmīgi pagatavo dažādu indikatoru maisījumus, tad to krāsa var mainīties plašās pH robežās. Šādus maisījumus sauc par universālindikatoriem. Ar indikatoru maisījumiem parasti piesūcina filtrpapīru, un pēc izžāvēšanas iegūst universālindikatora papīru.

Indikatoru lietošana ir ērta, vienkārša un samērā precīza pH vērtības noteikšanas metode, bet tai ir savi trūkumi. Ar indikatoru parasti var noteikt pH vērtību ar precizitāti līdz veselam skaitlim, tomēr medicīnā, lauksaimniecībā un vides kvalitātes noteikšanā bieži nepieciešami precīzāki mērījumi. Ar indikatoriem pH vērtību var noteikt tikai bezkrāsainiem šķīdumiem, lai precīzi varētu novērot krāsas maiņu.
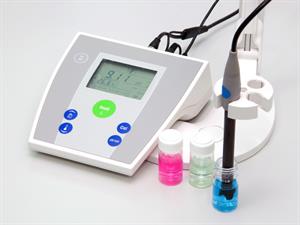
Instrumentālā pH vērtības noteikšanas metode ir pH mērīšana ar īpašu stikla elektrodu. Elektrodam atrodoties šķīdumā, tā virsmā sārmu metālu katjoni apmainās ar ūdeņraža joniem no šķīduma, un stikla virsma piesātinās ar ūdeņraža joniem. Tādējādi stikla virsma iegūst elektrisko lādiņu, kura lielums atkarīgs no šķidruma pH. Iekārtu, ar kuru nosaka pH vērtību, sauc par pH-metru. pH-metrs ir lietojams visā nepieciešamajā pH intervālā (no 0 līdz 14), mērījumi ir ļoti precīzi (līdz pat 0,001 pH vienībai). Ar digitālo pH-metru var nepārtraukti kontrolēt pH maiņu pētāmajā sistēmā.