Iztvaikošana un vārīšanās. Īpatnējais iztvaikošanas siltums.
Ja vaļējā traukā ielej šķidrumu, pēc noteikta laika var novērot, ka šķidruma līmenis traukā ir pazeminājies. Tas notiek šķidruma iztvaikošanas dēļ.
Iztvaikošana ir šķidruma pārvēršanās tvaikā — gāzveida stāvoklī.
Vienlaikus ar iztvaikošanu notiek pretējs process — kondensācija.
Kondensācija ir tvaiku pārvēršanās šķidrumā.
Iztvaikošana ir šķidruma pārvēršanās tvaikā — gāzveida stāvoklī.
Vienlaikus ar iztvaikošanu notiek pretējs process — kondensācija.
Kondensācija ir tvaiku pārvēršanās šķidrumā.
Dažādās vielas atšķiras ar daļiņu mijiedarbības potenciālās enerģijas lielumu. Tāpēc, lai iztvaicētu dažādas vielas, jāpievada atšķirīgs siltuma daudzums.
Īpatnējais iztvaikošanas siltums ir siltuma daudzums, kas nepieciešams, lai vārīšanās temperatūrā 1 kg vielas pārvērstu tvaikā. To mēra džoulos uz kilogramu (J/kg) un apzīmē ar burtu L.
Šķidruma intensīva iztvaikošana visā tā tilpumā ir vārīšanās. Katram šķidrumam ir sava vārīšanās temperatūra.
Vielas vārīšanās temperatūru var nolasīt no tabulas.
Pievadot enerģiju šķidrumam vārīšanās procesā, tā temperatūra nemainās. Visa pievadītā enerģija tiek patērēta, lai pārvarētu starpmolekulāros pievilkšanas spēkus un pārvērstu šķidrumu tvaikā.
Siltuma daudzums, kas nepieciešams šķidruma iztvaicēšanai vārīšanās temperatūrā: , kur
Q - siltuma daudzums;
L - vielas īpatnējais iztvaikošanas siltums vārīšanās temperatūrā, nolasa no tabulām;
m - šķidruma masa.
Q - siltuma daudzums;
L - vielas īpatnējais iztvaikošanas siltums vārīšanās temperatūrā, nolasa no tabulām;
m - šķidruma masa.
Svarīgi!
Kad tvaiks atdziest un sasniedz vārīšanās temperatūru, tas sāk kondensēties, tādā veidā turpinot atdot enerģiju apkārtējai videi. Lai norādītu, ka viela atdod siltumu, formulā dažreiz raksta mīnusa zīmi: .
Kondensācijas procesā daļiņu mijiedarbības potenciālā enerģija samazinās par Q. Daļiņu siltumkustības kinētiskā enerģija kondensācijas laikā nemainās, jo nemainās temperatūra.
Risinot uzdevumu, ir svarīgi zināt, vai viela jau ir sasniegusi vārīšanās temperatūru, vai arī tai vispirms jāpiešķir vai jāatdod enerģija, lai līdz tai nonāktu. Uzskatāmībai procesu var attēlot arī grafiski:
1) Sākuma temperatūra ir zemāka par vielas vārīšanās temperatūru. Novērojuma laikā temperatūra palielinās, līdz tiek sasniegta vārīšanās temperatūra. Secinājums: attēlotajā situācijā vielai tiek pievadīts siltuma daudzums.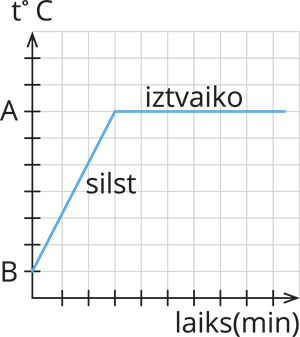 |
2) Sākuma temperatūra ir augstāka par vielas vārīšanās temperatūru. Novērojuma laikā temperatūra samazinās, līdz tiek sasniegta varīšanās temperatūra. Secinājums: attēlotajā situācijā siltuma daudzums no vielas tiek aizvadīts. 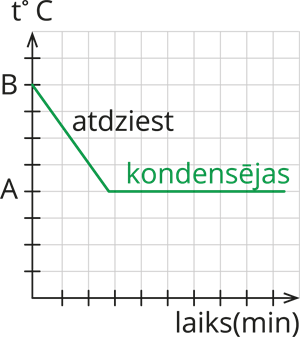 |