Gēnu terapija ir tehnoloģija, ar kuras palīdzību izmaina šūnas ģenētisko materiālu, lai ārstētu iedzimtas slimības vai slimības, ko izraisa dzīves laikā iegūtas mutācijas.
Gēnu terapijā izmanto gēnu inženierijas metodi, kurā pacientam ievada šūnai nepieciešamo terapeitisko gēnu vai bloķē nevēlama gēna darbību. Ģenētiskais materiāls tiek izmainīts somatiskajās, bet ne dzimumšūnās, tāpēc izmaiņas netiek pārmantotas nākamajās paaudzēs.
Pirmais veiksmīgais gēnu terapijas mēģinājums tika veikts 1990. gadā Lielbritānijā. Gēnu terapijas procedūru izdarīja 4 gadus vecai meitenei, kurai bija smags imūndeficīts, tā cēlonis — mutants ADA gēns. Cilvēkiem ar šo gēnu nestrādā imūnsistēma, un viņu dzīves ilgums nav garš, ja vien nedzīvo sterilā vidē, jo var nomirt no visniecīgākās infekcijas. Šajā gadījumā no meitenes kaulu smadzenēm tika izolētas T cilmes šūnās, kurās ievadīja ģenētiski pārveidotu vīrusu. Ģenētiski pārveidotais vīruss inficēja šīs cilmes šūnas un tajās esošais normālais ADA gēns iebūvējās T cilmes šūnu DNS molekulā. Pārveidotās T cilmes šūnas pavairoja audu kultūrā un pēc tam ievadīja meitenes organismā atpakaļ. Pēc gēnu terapijas procedūras meitene dzīvo pilnvērtīgu dzīvi.
Gēnu terapiju veic divejādi - ex vivo un in-vivo. Pirmais veiksmīgais gēnu terapijas gadījums tika veikts ex-vivo.
Svarīgi!
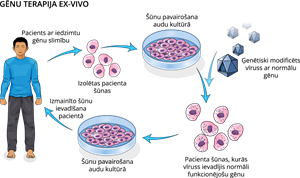
Gēnu terapija ex-vivo (latīņu valodā ex - ārpus, vivo - dzīvs) šūnu modificēšana notiek ārpus pacienta organisma.
No organisma paņem, piemēram, asins šūnas, tajās ievada vajadzīgo gēnu, un asins šūnas ievada atpakaļ organismā. Izmantojot gēnu terapiju cilmes šūnām, tā sniedz vislielāko efektu, jo gēnu pārmaiņas saglabājas arī nākamajām šūnu paaudzēm, kas veidojās no šīm šūnām. Katra organisma reakcija pēc šādas terapijas ir individuāla un grūti paredzama. Šajā gadījumā ir jārēķinās ar tādām pašām problēmām kā transplantācijas gadījumos, kaut arī atpakaļ ievadītās šūnas ir paša pacienta.
Transplantācija ir ķirurģiska operācija, kuras laikā dzīvas vai mirušas personas (donora) audi vai orgāni tiek pārstādīti citas personas (recipienta) organismā.
Dzīvie donori var ziedot audus (cilmes šūnas), kuri pēc noņemšanas atjaunojas, piemēram, kaulu smadzenes, kā arī orgānus, kuri neatjaunojas, bet cilvēks var dzīvot arī bez tiem, piemēram, viena niere. Kā donoru parasti izvēlas radiniekus vai personas, kurām ir saderība ar recipientu. No cilvēkiem, kas miruši, tiek izmantoti dažādi orgāni, piemēram, sirds, aizkuņģa dziedzeris, nieres, aknas, plaušas u.c. Ja mirušais dzīves laikā nav izdarījis savu izvēli par orgānu ziedošanu, to veic radinieki. Ja nav radinieki, tad juridiski tiek uzskatīts, ka cilvēks ir piekritis ziedot savus orgānus transplantācijai. Pirms transplantācijas tiek veikta imunoloģiskā pārbaude, lai pārbaudītu donora un recipienta saderību.
Pēc transplantācijas seko garš atlabšanas periods, kurā galvenā uzmanība tiek veltīta tam, lai pacientā nenotiktu atgrūšanas process. Atgrūšanas procesa laikā pacienta imūnā sistēma cīnās ar jauno orgānu vai audiem, un tā var mēģināt to iznīcināt. Ar šādām problēmām var saskarties arī gēnu terapijas ex-vivo gadījumā.
Svarīgi!
Gēnu terapija in-vivo (latīņu valodā in - iekšā, vivo - dzīvs) šūnu modificēšana notiek pacienta organismā.
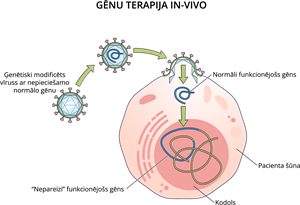
Gēnu terapijā in-vivo izmanto vīrusu, kuram izņemts ģenētiskais materiāls un pievienots vajadzīgais gēns. Ar šo ģenētiski modificēto vīrusu inficē cilvēku. Problemātiski ir nodrošināt, lai vīruss nokļūst vajadzīgajās šūnās un gēnu atbrīvo. Uz ievadītajiem vīrusiem var iedarboties imūnsistēma un tos iznīcināt. Šajā gēnu terapijas metodē tiek izmainīts ģenētiskais materiāls somatiskajās šūnās, tāpēc izmaiņas netiek nodotas nākamajām šūnu paaudzēm.
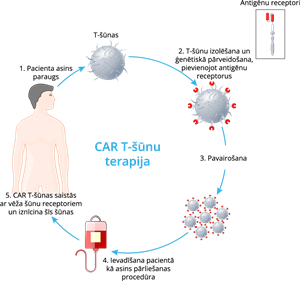
CAR T-šūnu terapija ir jauna veida imūnterapija, kas izmanto paša pacienta T-šūnas, lai atpazītu vēža šūnas un uzbruktu tām. Šīs pacienta T-šūnas tiek ģenētiski pārveidotas laboratorijā, tāpēc tagad uz to virsmas ir īpašas struktūras, ko sauc par himēriskajiem antigēnu receptoriem (CAR). CAR ir olbaltumvielas, kas ir paredzētas, lai pievienotos noteiktam mērķim vēža šūnās. Šis terapijas veids ir ļoti dārgs un tiek piemērots pacientiem pēc stingriem kritērijiem- ir kāda no B-šūnu (limfocītu) slimībām, citas terapijas procedūras nav sniegušas rezultātu utt. CAR T -šūnu terapijai ir iespējamas nopietnas blakusparādības.
Gēnu terapijas metodes turpmākajos gados turpinās strauji attīstīsies, dodot iespēju ārstēt iedzimtas slimības vai novērst iedzimtus defektus, kas līdz šim tika uzskatīti par neārstējamiem. Galvenie gēnu terapijas virzieni mūsdienās ir dažādi iedzimtie imūndeficīti, mukoviscidoze un dažādi vēžu gadījumi. Visvairāk ar gēnu terapiju nodarbojas ASV, tur tiek veiktas vairāk kā divas trešdaļas no visām ārstēšanas epizodēm.
Zinātnieki pēta un izstrādā arvien jaunas metodes, kā izmantot gēnu inženieriju slimību ārstēšanā. Viena no šādām metodēm ir CRISPR-Cas9 sistēma.
Zinātnieki pēta un izstrādā arvien jaunas metodes, kā izmantot gēnu inženieriju slimību ārstēšanā. Viena no šādām metodēm ir CRISPR-Cas9 sistēma.
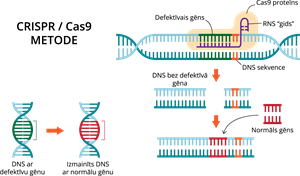
Ķīniešu zinātnieki 2015.gadā, izmantojot CRISPR/Cas9 sistēmas metodi, rediģēja 86 defektīvus cilvēka embrijus, kas tika iegūti no mākslīgās apaugļošanas klīnikas. Šī pētījuma mērķis bija izlabot gēnu, kas atbild par beta globīna (hemoglobīna sastāvdaļas) veidošanos. Ja šīs gēns ir defektīvs, organisms slimo ar slimību - beta talasēmija, kas var izraisīt nāvi. Rezultāti gan nebija tik veiksmīgi, kā tika cerēts, pozitīvs iznākums bija tikai četros gadījumos. Daudzos citos gadījumos bija pat citas, dzīvībai būtiskas izmaiņas, līdz ar to tika secināts, ka šī metode vēl nav pietiekami izpētīta klīniskam lietojumam.
Kādas angļu laboratorijas zinātnieki 21.gadsimta sākumā bija paziņoja, ka nav vajadzīgs sportistiem lietot nekādus ķīmiskus preparātus, bet var vienkārši pielikt tiem vajadzīgos gēnus lielākās dozās. Bija pat piemeklēti septiņi tādi kandidātgēni, ar kuru palīdzību varētu uzrādīt fantastiskus rezultātus sportā.
Gēnu dopings ir gēnu, gēnu elementu un šūnu neārstnieciska izmantošana, lai uzlabotu sportisko sniegumu.
Gēnu dopings ievada ģenētiski modificētas šūnas vai noteiktus gēnus, un dopinga vielas sintezē pats organisms atšķirībā no citiem dopinga veidiem, kad organismā ievada svešas vielas. Tas apgrūtina šī dopinga atklāšanu un paver pilnīgi jaunus apvāršņus dopinga lietošanai sportā. Šī iemesla dēļ Pasaules Antidopinga aģentūra (WADA) iekļauj gēnu dopingu pie aizliegtajām metodēm un iegulda lielus līdzekļus tā noteikšanai.
Tieši tāpat kā jebkurš cits dopinga veids, arī gēnu dopings ir sporta ētikas pārkāpums, jo kādiem sportistiem dod priekšrocības, kas nav citiem, un sasniegtie rezultāti nav godīgā sacensībā iegūti.
Gēnu dopings ir saistīts ar riskiem un blakusparādībām, kas rodas tāpat kā citos gadījumos, kad tiek veiktas medicīniskas manipulācijas ar cilvēka organismu, šajā gadījumā gēnu līmenī.
Gēnu inženierijas metodes izmantošana joprojām ir eksperimentālu pētījumu laukā, un var radīt dažādus riskus cilvēka veselībai. Gēnu dopings var izraisīt neparedzamas imūnsistēmas slimības, vēzi, orgānu izmaiņas utt. Vēl viena problēma, ar ko var saskarties gēnu dopings, ir tāda, ka pēc ģenētiskās modifikācijas, ja tās veiktas cilmes šūnām, šūnas turpinās sintezēt atbilstošās vielas visu mūžu. Tas var izraisīt neatgriezeniskas izmaiņas endokrīnajā sistēmā un nepareizu iekšējo orgānu darbību.