Ķīmisko reakciju siltumefekts
Tā ir sakarība starp reakcijas siltumu pie konstanta spiediena un konstanta tilpuma.
Ķīmiskās reakcijas siltumefekts - siltuma daudzums, kas izdalās vai, ko paterē reakcijas gaitā pie noteikuma, ja reakcija noris pie konstanta spiediena vai konstanta tilpuma.
Ķīmiskās reakcijas enerģijas izdalīšanās vai uzņemšana notiek galvenokārt siltuma (Q)veidā.
Ja reakcija notiek pie nemainīga tilpuma (V), tad saskaņā ar pirmo termodinamikas likumu reakcijas siltumefektu izsaka:
Toties, ja reakcija noris pie nemainīga spiediena, tad saskaņā ar pirmo termodinamikas likumu reakcijas siltumefektu izsaka:
Iekšējā enerģija
Sistēmas iekšējā enerģija (U) ir tās pilnā enerģija, kuru iegūst, summējot molekulu kustības enerģiju, kodolu un elektronu kustības enerģiju molekulās un atomos, kodolu iekšējo enerģiju, starpmolekulārās mijiedarbības enerģiju u.tml. (t.i., visu veidu enerģijām izņemot sistēmas kā viena vesela kinētisko un potenciālo enerģiju).
Ideālās vienatomu gāzes iekšējā enerģija ir gāzes visu molekulu siltumkustības kinētisko enerģiju summa, jo ideālās gāzes modelī neņem vērā molekulu savstarpējo mijiedarbību:
, kur
U - iekšējā enerģija, m - gāzes masa, M - gāzes molmasa, R = 8,31 J/(mol·K) - universālā gāzu konstante,T - absolūtā temperatūra.
Gan darbs, gan siltuma daudzums raksturo iekšējās enerģijas izmaiņu. Pirmais termodinamikas likums nosaka kvantitatīvās attiecības starp šiem lielumiem. Termodinamiskās sistēmas iekšējā enerģija pieaug par lielumu ΔU divu iemeslu dēļ – ja tai tiek pievadīts siltuma daudzums Q vai arī ārēji spēki veic darbu A. Saskaņā ar pirmo termodinamikas likumu:
Rašanās siltums jeb Entalpija
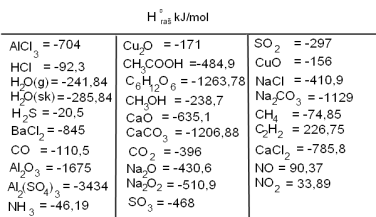
Jēdziens rašanās siltums apzīmē reakcijas siltumefektu, veidojoties vienam molam vielas no vienkāršām vielām. To apzīmē ar .
Pieņem, ka vienkāršu vielu standartentalpijas, ja vielas standartapstākļos ir stabilas, vienādas ar nulli.
Reakcijas siltumefekts ir vienlīdzīgs reakcijas produktu rašanās siltumu summas un izejvielu rašanās siltumu summas starpībai. (Aprēķinos jāņem vērā stehiometriskie koeficienti!).
Ja ir negatīvs, tad reakcija ir eksotermiska, ja pozitīvs - tad endotermiska.
Termoķīmiskie vienādojumi
Ķīmiskos (stehiometriskos) vienādojumus, kuros ir uzrādīti reakciju siltumefekti jeb entalpijas izmaiņas, kā arī visu vielu agregātstāvokļi, sauc par termoķīmiskajiem vienādojumiem.
|
|
veidojas ūdens tvaiki (g) | |
|
|
veidojas ūdens (š) | |
|
|
veidojas ledus kristāli (kr)
|
Atsauce:
N.Ahmetovs "Neorganiskā ķīmija" 183.-186.lpp
A.Buiva "Vispārīgā ķīmija vidusskolām" 120.-125.lpp
https://moodle.rtu.lv/public/course/view.php?id=38809