Entropija
Entropija ir sistēmas haosa mērs. Tā raksturo sistēmas stāvokļa varbūtību jeb nesakārtotību.
Patvaļīgi noritošos procesos nesakārtotība un līdz ar to entropija tikai pieaug. Šo procesu entropijas maiņu aprēķina:
Tas vienmēr ir pozitīvs lielums.
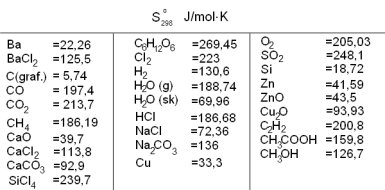
Dažādu vielas stāvokļu varbūtību var aprakstīt kā jebkuru tās īpašību, kvantitatīvi raksturojot ar entropijas skaitlisko vērtību ( vai ). Standartapstākļos aprēķināto vielu entropijas sauc par standartentropijām .
Vielu entropijas vērtības izmanto, nosakot sistēmas entropijas izmaiņas attiecīgu procesu rezultātā. Tā ķīmiskai reakcijai sistēmas entropijas izmaiņa ir:
Trutona likums
Iztvaikošanas entropijas izskaidro empīrisko sakarību, ko sauc par Trutona likumu. Trutons pamanīja, ka iztvaikošanas entropiju vērtības ir apmēram vienādas visiem šķidrumiem, izņemot tos, kuros veidojas stipras ūdeņraža saites vai notiek citas specifiskas mijiedarbības. Šī aptuvenā vienādība ir viegli izskaidrojama - šķidrumam iztvaikojot, kompaktā kondensētā fāze pāriet plaši izkliedētā gāzē, kas ieņem apmēram tādu pašu tilpumu, neraugoties uz vielas identitāti.
Atsauce:
N.Ahmetovs "Neorganiskā ķīmija" 191.-193.lpp
https://moodle.rtu.lv/public/course/view.php?id=38809