Oksidēšanās - reducēšanās jēdziens
Par oksidēšanās - reducēšanās reakcijām jeb redoksreakcijām sauc tādas ķīmiskas reakcijas, kuru gaitā izmainās reaģējošo vielu sastāvā ietilpstošo ķīmisko elementu oksidēšanas pakāpes, jo elementu atomi viens otram atdod un pievieno elektronus.
Vielas, kas šādās reakcijās elektronus atdod jeb zaudē, sauc par reducētājiem, bet pašas tās oksidējas.
Bet vielas, kas šādās reakcijās elektronus pievieno jeb iegūst, sauc par oksidētājiem, bet pašas tās reducējas.
Svarīgi!
Oksidēšanās un reducēšanās ir savstarpēji saistīti, viens no otra neatraujami procesi - ja kāda viela oksidējas, cita neizbēgami reducējas.
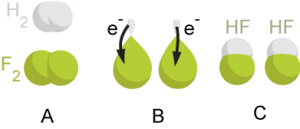
Attēlā redzams redoksreakcijas piemērs - ūdeņradis atdod savus elektronus sevišķi spēcīgam oksidētājam - fluoram un rodas fluorūdeņradis.
Oksidēšanās - reducēšanās reakciju veidi
Izšķir trīs oksidēšanās - reducēšanās reakciju veidus: 1) starpmolekulārās; 2) iekšmolekulārās; un 3) pašoksidēšanās - pašreducēšanās reakcijas.
1) Starpmolekulārās oksidēšanās-reducēšanās reakcijas - šīs ir visizplatītākās oksidēšanās-reducēšanās reakcijas un tajās oksidējamie un reducējamie atomi atrodas dažādu vielu molekulās.
2) Iekšmolekulārās oksidēšanās-reducēšanās reakcijas - šādās reakcijās oksidējamie un reducējamie atomi atrodas vienas un tās pašas vielas molekulās.
3) Pašoksidēšanās-pašreducēšanās reakcijas jeb disproporcionēšanās reakcijas - tādās reakcijās daļai viena un tā paša elementa atomu oksidēšanas pakāpe paaugstinās, bet daļai - samazinās.
Atsauce:
http://lv.wikipedia.org/wiki/Oksid%C4%93%C5%A1an%C4%81s-reduc%C4%93%C5%A1an%C4%81s_reakcijas