Atoma kodols aizņem pavisam niecīgu daļu - aptuveni simttūkstošo daļu no visas atoma telpas. Kodolu aptver elektronu apvalks, ko veido negatīvi lādētie elektroni. Kodola pozitīvais lādiņš elektronus pievelk, un tāpēc tie parastos apstākļos neiziet ārpus atoma telpas. Elektrona masa ir tik niecīga, ka tā kustību un stāvokli atomā nevar aprakstīt, izmantojot priekšstatus par masas punktu un mehānikas likumsakarības. Mūsdienās zinātnieki uzskata, ka elektrona kustībai piemīt viļņa īpašības.
Atoma telpā dažādās vietās elektrons var atrasties ar atšķirīgu varbūtību. Ja uzzīmētu elektrona atrašanās varbūtības sadalījumu grafiski, tas veidotu it kā mākoni, kuram dažādās vietās ir atšķirīgs blīvums. Šis mākonis aizņem atoma telpas daļu, kurā ar noteiktu varbūtību atrodas elektrons un ko sauc par elektrona orbitāli.
Par elektronu orbitāli uzskata atoma telpas daļu, kurā ar noteiktu varbūtību (90%) atrodas elektrons.
Mūsdienās elektrona kustību, tā mijiedarbību ar kodolu un citiem elektroniem atomos un molekulās pēta dabaszinātņu nozare - kvantu mehānika. Lai raksturotu elektrona enerģiju, orbitāles formu un citus lielumus, zinātnieki izmanto četrus kvantu skaitļus. Kvantu skaitļiem doti īpaši nosaukumi: galvenais kvantu skaitlis, orbitālais kvantu skaitlis, magnētiskais kvantu skaitlisun spina kvantu skaitlis.
Galvenais kvantu skaitlis n raksturo elektrona enerģiju un nosaka enerģijas līmeni, kurā šis elektrons atrodas. Enerģijas līmeni skaitliski izsaka ar veselu skaitli. Ķīmisko elementu atomu galvenie kvantu skaitļi n = 1, 2, 3, 4, 5, 6, 7. Ķīmisko elementu periodiskajā tabulā tam atbilst periodu numuri. Jo lielāks n, jo lielāks orbitāles rādiuss.
No elektrona enerģijas atkarīgs, cik tālu tas savā kustībā var attālināties no kodola. Elektroni, kam piemīt vismazākais enerģijas krājums (n = 1), novietojas pirmajā enerģijas līmenī. Ja šie elektroni iegūst enerģijas kvantu (noteiktu porciju), tad tie pāriet otrajā enerģijas līmenī.
Orbitālais kvantu skaitlis l nosaka elektrona orbitāles formu. Visu elementu atomos, izņemot ūdeņraža atomu, kam ir tikai viens elektrons, papildus elektrisko lauku rada citu elektronu klātbūtne. Papildus elektriskā lauka ietekmē elektrona enerģija mainās un orbitāle maina savu ģeometrisko formu.
Kvantu mehānikā pieņemts teikt, ka elektronu enerģijas līmeņi sašķeļas enerģijas apakšlīmeņos, un tos apzīmē ar burtiem s, p, d un f. Ja elektrons atrodas s apakšlīmenī, tad elektronu orbitāles ir lodveida. Ja elektrons atrodas p apakšlīmenī, tad elektrona orbitālei ir hanteles forma. Savukārt d apakšlīmenī elektronu orbitāles formu varētu raksturot kā divas hanteles, bet nākošajos apakšlīmeņos veidojas vēl sarežģītākas formas orbitāles.
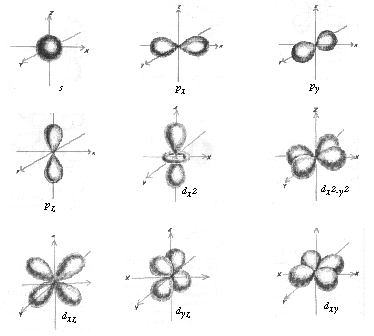
Magnētiskais kvantu skaitlis m parāda elektronu mākoņa telpisko orientāciju attiecībā pret kodolu. Atomos elektronu orbitāles ietekmē arī magnētiskais lauks. Sfēriskā s elektronu orbitāle ir pilnīgi simetriska. Lai kādā virzienā to šķērsotu magnētiskā lauka spēka līnijas, nekādu izmaiņu tās novietojumā attiecībā pret kodolu nevar būt. Savukārt p un d orbitāles attiecībā pret koordinātu asīm var atrasties vairākos veidos.
Katrā orbitālē var atrasties vai nu viens, vai divi elektroni. Ja vienā orbitālē atrodas divi elektroni, tad tos sauc par sapārotiem elektroniem jeb par elektronu pāri. Elektrons nevar izveidot pāri ar jebkuru citu elektronu. To nosaka elektroniem piemītošais spins jeb spina kvantu skaitlis , kas raksturo elektrona rotācijas virzienu ap savu asi. Lai izveidotos elektronu pāris, rotācijai jānotiek pretējos virzienos, bet pārējie kvantu skaitļi var būt vienādi. Ja pieņem, ka elektroni ir mazi magnētiņi, tad, izveidojot elektronu pāri, šo magnētiņu poli vērsti pretējos virzienos.
Elektrona orbitāles izvietojumu atomā attēlo ne tikai ar telpiskiem modeļiem, bet arī simboliski. Kā orbitāles simbolisks apzīmējums šajā gadījumā kalpo kvadrātiņš. Ja orbitālē izvietojies viens elektrons, to parāda ar vertikālu bultiņu, bet ja izvietojies elektronu pāris, tad iezīmē vēl otru pretēji vērstu bultiņu. Atoma elektronu apvalka uzbūvi raksturo ar atomu elektronformulām, kurās galvenais kvantu skaitlis parādīts ar ciparu (1, 2, 3, 4, 5, 6, 7) un orbitālais kvantu skaitlis ar atbilstošu burtu (s, p, d, f). Elektronu skaitu apakšlīmenī norāda kāpinātājs pie enerģijas apakšlīmeņa simbola.
Enerģijas līmeņi un apakšlīmeņi daudzelektronu atomos aizpildās ar elektroniem atbilstoši enerģijas minimuma principam, t.i., sākot ar tiem līmeņiem un apakšlīmeņiem, kuros elektronam ir vismazāk enerģijas. Atbilstoši šim principam elektroniem vajadzētu pilnīgi aizpildīt visus viena enerģijas līmeņa apakšlīmeņus un tikai tad sākt izvietoties nākamajā - enerģijas ziņā augstākajā līmenī. Izrādās, ka šī secība ir spēkā tikai pirmajos divos enerģijas līmeņos. Jo augstāks enerģijas līmenis, jo vairākos apakšlīmeņos tas sašķeļas. Sašķelšanās rezultātā var izrādīties, ka zemākā līmeņa n = 3 apakšlīmeņa 3d enerģija ir augstāka par augstākā līmeņa n = 4 apakšlīmeņa 4s enerģiju.
Enerģijas apakšlīmeņu aizpildīšanās norisinās pēc vācu fiziķa Frīdriha Hunda atklātā likuma, kas nosaka, ka orbitālēs vispirms novietojas pa vienam elektronam un tikai pēc tam sāk veidoties elektronu pāri ar pretējiem spiniem .
Piemērs:
Sēra S atoma elektronformulas izveidošana, izmantojot orbitāļu un elektronu simboliskos apzīmējumus.
