Vielas cietā stāvoklī
Kristālisko vielu daļiņu regulārais izkārtojums ārēji izpaužas regulāru ģeometrisku ķermeņu - kristālu - veidā. Tos klasificē pēc daļiņu izvietojuma telpā un pēc tā, kāds raksturs ir saitei starp daļiņām, kas veido kristālu.
Kubiskā sistēma. Simetrijas asis ir savstarpēji perpendikulāras un vienādas. Šādi kristalizējas daudzi metāli, dimants, sāļi (NaCl, KCl u.c.); kopumā aptuveni 8% savienojumu. | 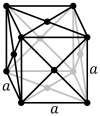 |
| Tetragonālā sistēma. Simetrijas asis ir savstarpēji perpendikulāras, bet viena no tām ir īsāka vai garāka. Pie šīs sistēmas pieder tetragonāla bipiramīda un tetragonāla prizma. Šādi kristalizējas vairāki oksīdi, alva, vairāki sāļi; aptuveni 5% savienojumu. | 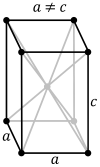 |
Heksagonāla sistēma. Šai sistēmai ir četras simetrijas asis. Galvenā ass novietojas perpendikulāri pārējām trim simetrijas asīm, kas ir vienādas un savā starpā veido lielu leņķi. Heksagonālās sistēmas piemēri var būt heksagonāla bipiramīda, romboedrs un heksagonāla prizma. Šādi kristalizējas metāli (Mg, Zn), oksīdi, sāļi (HgS), ūdens; aptuveni 7% savienojumu. | 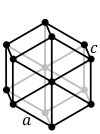 |
Rombiskā sistēma. Simetrijas asis savstarpēji perpendikulāras, bet savā starpā nav vienādas. Sistēmas piemēri ir rombiskā prizma un rombiskā bipiramīda. Šādi kristalizējas sērs, sāļi (); aptuveni 28% savienojumu. | 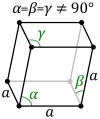 |
Monoklīnā sistēma. Divas simetrijas asis ir savstarpēji perpendikulāras, bet trešā ir noliekta attiecībā pret vienu no perpendikulārajām asīm. Sistēmas piemēri ir monoklīnoedriskā prizma un monocikliskā piramīda. Šādi kristalizējas sērs, cukurs, sāļi (); aptuveni 42% savienojumu. | 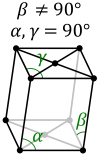 |
Triklīnā sistēma. Visas trīs asis novietotas noteiktā leņķī cita pret citu, un tām ir dažāds garums. Sistēmas piemēri ir triklīnoedriskā piramīda un triklīnoedriskā prizma. Kristalizējas sāļi (); aptuveni 10% savienojumu. | 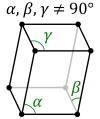 |
Pēc saites rakstura starp daļiņām kristālā raksturīgi četri kristālrežģu veidi:1) jonu kristālrežģis; 2) atomu kristālrežģis; 3) molekulu kristālrežģis; 4) metālu kristālrežģis.
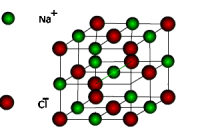 | Jonu kristālrežģi veido regulāri izvietoti pretēji lādēti joni. Saites starp joniem kristālā ir noturīgas, tādēļ vielas ar jonu kristālrežģi ir samērā cietas, grūti kūstošas un maz gaistošas. Šāds režģis raksturīgs neorganiskajiem sāļiem, piemēram, metālu halogenīdiem, sulfātiem, nitrātiem u.c. |
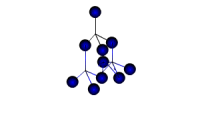 | Atomu kristālrežģi veido neitrāli atomi, kas savā starpā saistīti ar kovalento saiti. Šāds kristālrežģis ir dažām vienkāršām vielām un dažiem savienojumiem, piemēram, dimantam, boram, silīcijam. Kovalentā saite ir ļoti izturīga, tādēļ vielas ar atomu kristālrežģi ir ļoti cietas, grūti kūstošas un maz gaistošas, tās nešķīst nevienā zināmā šķīdinātājā. |
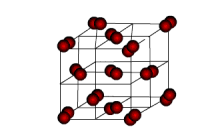 | Molekulu kristālrežģi veido molekulas, kas var būt gan polāras, gan nepolāras. Vielām ar molekulu kristālrežģi ir samērā zema cietība un arī zema kušanas temperatūra. Tāpēc tās parastos apstākļos ir gāzes vai viegli gaistoši šķidrumi un cietvielas. Šāds režģis ir hlorūdeņradim, amonjakam, ledum u.c. |
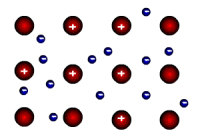 | Metālu kristālrežģa mezglu punktos atrodas pozitīvi joni un metāla atomi, bet starp šīm daļiņām pārvietojas elektroni, kas ar joniem un atomiem ir vāji saistīti. Brīvie elektroni metālos nosaka metālu būtiskākās īpašības, piemēram, elektrovadītspēju, siltumvadītspēju, metālisko spīdumu. |
Dažas kristāliskas vielas, kas pēc ķīmiskā sastāva ir līdzīgas, veido vienādas formas kristālus. Šādas vielas sauc par izomorfām, bet parādību, ka pēc ķīmiskā sastāva līdzīgām vielām ir vienādas formas kristāli sauc par izomorfismu.
Savukārt par polimorfismu sauc īpašību, kad vielas, kas var kristalizēties veido dažādas formas kristālus. Polimorfisms ir jāatšķir no alotropijas.
Parādību, ka viens un tas pats elements veido vairākas vienkāršas vielas, sauc par alotropiju.
Atsauce:
http://alhimikov.net/elektronbuch/Page-11.html
http://lv.wikipedia.org/wiki/Krist%C4%81lisk%C4%81_strukt%C5%ABra