Kovalentā saite
Kovalentā saite, saukta arī par homeopolāro saiti, ir ķīmiskā saite, ko veido divu atomu kopīgs elektronu pāris.
Valences saišu metode skaidro, ka katra kovalentā saite pieder diviem atomiem, kuriem ir kopīgs viens elektronu pāris. Atomu pāris var veidot vairākas kovalentās saites, ja to atļauj valences elektronu skaits, un tādas saites sauc par divkāršām vai trīskāršām saitēm.
Molekulāro orbitāļu metode molekulu apraksta, kā vienu veselu kopumu, kurā katru elektronu ietekmē pārējie molekulas elektroni un atomu kodoli. Metode pieņem, ka molekulā, tāpat kā atomā, visi tās elektroni izvietoti pa noteiktām orbitālēm.
Ir divu veidu kovalentās saites:
Nepolārā kovalentā saite, kura veidojas starp viena un tā paša ķīmiskā elementa atomiem.
Polārā kovalentā saite, kura veidojas starp elementu atomiem, kuru elektronegativitātes atšķiras.
Sigma un Pī kovalentā saite
Ja orbitāļu pārklāšanās apgabals atrodas uz līnijas, kura saista atomu kodolus, tad šādu saiti sauc par sigma saiti.
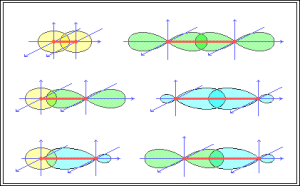
Attēlā saite.
Ja orbitāļu pārklāšanās apgabals atrodas plaknē, kura ir perpendikulāra līnijai, kas saista atomu kodolus, tad šādu saiti sauc par pī saiti.

Attēlā saite.
Pī saites enerģija ir apmēram 10 reizes mazāka par sigma saites enerģiju.
Svarīgi!
Ja starp diviem atomiem pastāv tikai viena kovalentā saite, tad tā ir sigma saite, bet, ja starp diviem atomiem ir divas vai vairāk saites, tad viena no tām ir sigma, bet pārējās ir pī saites.
Atsauce:
http://lv.wikipedia.org/wiki/Kovalent%C4%81_saite
http://ru.wikipedia.org/wiki/%D0%9F%D0%B8-%D1%81%D0%B2%D1%8F%D0%B7%D1%8C
http://ru.wikipedia.org/wiki/%D0%A1%D0%B8%D0%B3%D0%BC%D0%B0-%D1%81%D0%B2%D1%8F%D0%B7%D1%8C