Orbitāļu hibridizācija
Hibridizēto orbitāļu veidošanos pirmais izskaidroja amerikāņu zinātnieks L.K.Polings.
Hibridizācija ir atoma dažādu apakšlīmeņu elektrona orbitāļu pārveidošanās, kuras rezultātā veidojas jaunas formas orbitāles.
| Tā var notikt starp dažādiem elektroniem. Piemēram, viena s elektrona un viena p elektrona orbitāļu hibridizācija (sp hibridizācija) notiek, veidojoties berilija, cinka vai dzīvsudraba halogēnu molekulām. | 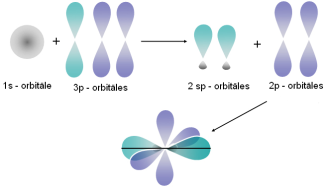 |
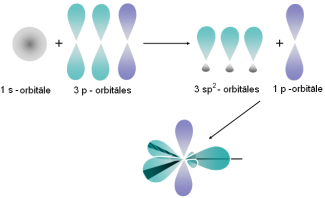 | Var pārveidoties arī viena s elektrona un divu p elektronu orbitāles ( hibridizācija). Šāda hibridizācija iespējama, piemēram, molekulā. |
Tāpat var pārveidoties viena s elektrona orbitāle un trīs p elektronu orbitāles, veidojot četras jaunas (hibridizētas) orbitāles. Šāds hibridizācijas veids ir oglekļa atoma gadījumā. Orbitāle veido tetraedrisku formu. | 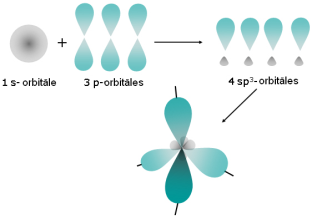 |
Ja ņem vērā elektronu orbitāļu pārklāšanos un hibridizāciju, molekulās vērtības leņķiem būtu jābūt lieliem. Tomēr daudzās molekulās tas tā nav.
To var izskaidrot, ka vienlaicīgi ar ķīmisko saišu veidošanos notiek arī orbitāļu savstarpējā atgrūšanās. Nemetālisko elementu atomi, kuros ir divi nesapāroti elektroni, veido molekulas, kurās vērtības leņķis ir nedaudz lielāks par , bet atomi, kuros ir trīs nesapāroti elektroni, veido molekulas,kurām ir tetraedriska forma.
Saitei starp dažādu elementu atomiem ir lielāka vai mazāka saites polaritāte. Saite var būt polāra, nepolāra vai jonu saite. Saites polaritāti raksturo pozitīvais vai negatīvais daļlādiņš, ko sauc par efektīvo lādiņu.
Arī molekulas var būt polāras un nepolāras. Nepolārās molekulās pozitīvo un negatīvo lādiņu smaguma centri sakrīt. Polārās molekulas ir dipoli, t.i., sistēmas, kas sastāv no diviem vienāda lieluma, bet pretējas zīmes lādiņiem. Molekulu polaritāti raksturo tās dipolmoments, ko mēra debajos (D).
Atsauce:
http://www.ntu.ac.uk/cels/molecular_geometry/hybridization/Sp_hybridization/index.html
http://www.ntu.ac.uk/cels/molecular_geometry/hybridization/Sp2_hybridization/index.html
http://www.ntu.ac.uk/cels/molecular_geometry/hybridization/Sp3_hybridization/index.html