Elementa vērtības
Par ķīmiskā elementa vērtību sauc dotā elementa atoma spēju pievienot sev noteiktu citu atomu skaitu.
Vēlāk, attīstoties Rezerforda-Bora atoma teorijai, Nilss Bors mēģināja izskaidrot ķīmisko saiti ar elektronu kustību pa orbītu, kuras plakne perpendikulāra līnijai, kas savieno saistīto atomu kodolus.
Savukārt jonu tipa savienojumos saite veidojas, pievelkoties pretēji lādētiem joniem.
|
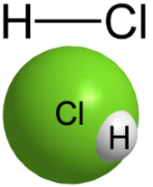
Hlora atoms spēj sev pievienot 1 ūdeņraža atomu.
 |
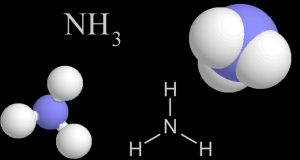
Slāpekļa atoms spēj pievienot 3 ūdeņraža atomus.
 |
|
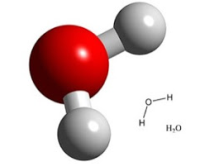
Skābekļa atoms spēj pievienot 2 ūdeņraža atomus.
 |
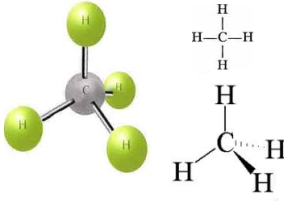
Oglekļa atoms spēj pievienot 4 ūdeņraža atomus.
 |
Vērtību apzīmē ar romiešu cipariem un pieraksta virs elementa simbola (). Elementa vērtība var būt no 1- 8.
Ir elementi ar nemainīgu vērtību, piemēram, ūdeņradis.
Ir elementi ar mainīgu vērtību.
Piemērs:
Dzelzs savienojumos ar citiem elementiem var būt divvērtīgs vai trīsvērtīgs.
Ja vielas sastāvā ir divi ķīmiskie elementi, tad viena elementa vērtību summai ir jābūt vienādai ar otra elementa vērtību summu.