Elektrodu standartpotenciāls
Lai kvalitatīvi raksturotu to vielu oksidējošo - reducējošo aktivitāti, kuras atrodas šķīdumos vai saskaras ar tiem, izmanto tā sauktos elektrodu jeb oksidēšanās - reducēšanās potenciālus E.
Ja jonu koncentrācija vienāda ar vienu, tad potenciālu starpību sauc par sistēmas elektroda standartpotenciālu un apzīmē ar . Par standarttemperatūru pieņem .
Elektrodu (oksidēšanās - reducēšanās) potenciālu vērtības parasti attiecina pret sistēmu: , kuras standartpotenciālu pieņem . Šo sistēmu sauc par ūdeņraža elektrodu. | 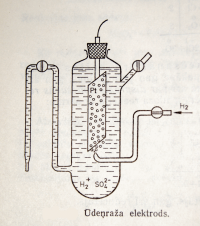 |
Pēc elektronu standartpotenciāliem var spriest par oksidēšanās reducēšanās sistēmu īpašībām.
Piemērs:
Standartpotenciāli sistēmām attiecīgi ir +2,87 V un -2,23 V. Tāpēc molekulai ir stipri izteiktas oksidējošās īpašības, bet jonam - reducējošās īpašības.
Elektrodu potenciālu vērtības ir atkarīgas no vielas oksidētās un reducētās formas koncentrāciju attiecības, kā arī no temperatūras, šķīdinātāja dabas, vides pH u.c.
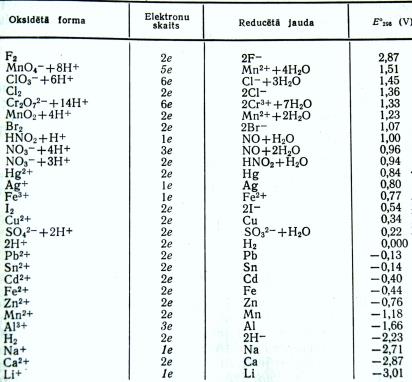
Attēlā parādīti daži oksidēšanās - reducēšanās sistēmu elektrodu standartpotenciāli standarttemperatūrā.