Elektronu kustība atomos
Elektronu kustība atomos ir telpiska trīsdimensiju svārstību kustība , ko iespējams salīdzināt ar stāvviļņiem. Stāvvilnim katrā vietā ir sava raksturīga svārstību amplitūda. Punktus, kuros kustība nenotiek sauc par mezgliem, bet par blīzumiem sauc divu blakus esošu mezglu viduspunktus, kuros amplitūda ir maksimāla.
Pieņemts, ka telpas daļu, kurā elektrona atrašanās varbūtība ir 95%, sauc par orbitāli (elektronu mākoni). Orbitāles telpiskā forma un izmēri ir atkarīgi no enerģijas krājuma.
Kvantu skaitļi
Galvenais kvantu skaitlis (n) nosaka elektrona enerģijas krājumu un vidējo attālumu no kodola. Galvenais kvantu skaitlis var būt jebkurš vesels skaitlis no 1 līdz bezgalībai. Šis skaitlis nosaka elektrona atrašanos noteiktā elektronu enerģijas līmenī. Maksimāli iespējamo elektronu skaitu N katrā līmenī aprēķina pēc formulas .
Elektronu orbitāles ģeometrisko formu raksturo orbitālais kvantu skaitlis (l). Citi tā nosaukumi ir blakus kvantu skaitlis un azimutālais kvantu skaitlis. Tā vērtības var būt no 0 līdz (n-1). Orbitālais kvantu skaitlis norāda enerģētisko apakšlīmeņu skaitu, tas ir vienāds ar galveno kvantu skaitli.
Pirmajā enerģijas līmenī var būt tikai viens orbitālā kvantu skaitļa noteiktais s apakšlīmenis, otrajā enerģijas līmenī - s un p apakšlīmeņi, trešajā - s, p un d apakšlīmeņi, bet ceturtajā - s, p, d un f apakšlīmeņi. Maksimāli iespējamo elektronu skaitu konkrētajā apakšlīmenī nosaka pēc formulas .
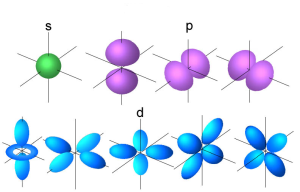
Attēlā redzams, ka grafiski attēloti s elektronu orbitāle ir sfēriska, p elektronu orbitāle ir hanteļveida, d elektronu orbitāli pieņemt saukt par ziedveida, bet f elektronu orbitāli sarežģītības dēļ grafiski attēlo reti.
Magnētiskais kvantu skaitlis (m) raksturo elektronu orbitāles novietojumu telpā. Tā vērtība ir atkarīga no orbitālā kvantu skaitļa, un šīs vērtības var būt no - l līdz + l ieskaitot nulli.
Spina kvantu skaitlis (s) raksturo elektrona kustību jeb rotāciju ap savu asi. Spina kvantu skaitļu vērtības var būt -1/2 un +1/2 . Šie skaitļi norāda, ka elektrons var rotēt pulksteņa rādītāju kustības virzienā vai pretēji tam.
Svarīgi!
Atoma elektronapvalkā nevar būt divu elektronu, kam visi četri kvantu skaitļi ir vienādi.