Vielu šķīdība
| Pēc šķīdības līknes iespējams noteikt vielas šķīdību noteiktā temperatūrā. Izmantojot šķīdības līknes, var noteikt šķīduma veidu – piesātināts šķīdums, nepiesātināts šķīdums vai pārsātināts šķīdums. | 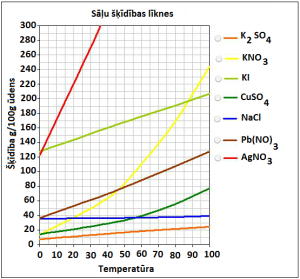 |
Šķīdumu, kurā šķīdināmā viela dotajā temperatūrā vairs nešķīst, sauc par piesātinātu šķīdumu.
Šķīdumu, kurā šķīdināmo vielu dotajā temperatūrā vēl var izšķīdināt, sauc par nepiesātinātu šķīdumu.
Pārsātināts ir šķīdums, kas dotajā temperatūrā satur vairāk izšķīdušās vielas nekā nepieciešams, lai šķīdums būtu piesātināts.
Šķīdinātājs ir viela kurā tiek izšķīdināta vajadzīgā viela, šķīdinātājs ir, piemēram, ūdens.
Piesātināta šķīduma pagatavošana
Uzdevums: Cik grami vārāmās sāls šķīdīs 200 ml ūdens 20 grādu temperatūrā.
Risinājums: No literatūras avotiem noskaidrojam , ka vārāmās sāls šķīdība ūdenī 20 grādu temperatūrā ir 38. grami. 100 gramos ūdens. 200 mililitros ūdens izšķīdīs 76 g. vārāmās sāls, to var noskaidrot pēc proporcijas:
100 ml ūdens šķīst 38. grami vārāmās sāls 200 ml ūdens šķīst x grami vārāmās sāls | x= =76 g |
Praktiskie soļi šķīduma pagatavošanai
1. Veic nepieciešamos aprēķinus
2. Izvēlās nepieciešamos traukus - vārglāzi, mērcilindru, strūkleni, svarus, stikla nūjiņu.
3. Veic nepieciešamās darbības un pagatavo šķīdumu:
• Uz svariem novieto vārglāzi, nospiež pogu "tare", iesver nepieciešamo vārāmās sāls masu.
• No strūklenes mērcilindrā ielej attiecīgo ūdens tilpumu mililitros.
• Ūdeni ielej vārglāzē (vārglāzi noņem no svariem), kur atrodas sāls un šķīdumu maisa ar stikla nūjiņu līdz vārāmā sāls ir izšķīdusi.