Oksidēšanās
Ķīmiskas reakcijas, procesus, kuru gaitā kāds elements zaudē un kāds elements pieņem elektronus sauc par oksidēšanās-reducēšanās reakcijām.
Kā piemēru var apskatīt nātrija (Na) reakciju ar sēru (S).
Nātrijam ārējā enerģijas līmenī ir 1 brīvs elektrons, bet sēram 6, pie tam sēra elektronegativitāte ir lielāka nekā nātrijam, jo tas ir nemetāls. Tas nozīmē, ka nātrijs zaudē elektronu, jo tas ir "vājāks" nekā sērs.
Takā sēram, lai aizpildītu savu ārējo enerģijas līmeni ir nepieciešami 2 elektroni, tas savienojas ar 2 nātrijiem, jo katrs nātrijs var dot tikai 1 elektronu.
To var attēlot ar shēmu šādi:
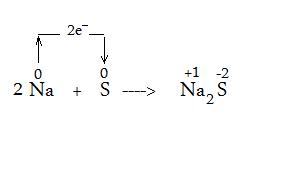
Šajā shēmā ir parādīts, ka 2 nātriji zaudē kopā 2 elektronus, kuri pāriet pie sēra, veidojot nātrija sulfīdu, pie tam, nātrija sulfīdam virs elementu simboliem ir rakstīts cik elektronus elements ir zaudējis un cik pieņēmis. Nātrijam ir +1, jo molekulā ir 2 nātriji un katrs ir zaudējis vienu.
Svarīgi ir atcerēties, ka vienkāršām vielām kā piemēram nātrijam (Na), sēram (S), kalcijam (Ca) utt, oksidēšanās pakāpe ir 0, jo tie nav ne pieņēmuši ne zaudējuši elektronus. Tas pats attiecās arī uz vienkāršu vielu molekulām kā skābeklis (), slāpeklis un halogēni (), šajos savienojumos elementi nav "iedevuši" vai "atņēmuši" elektronus, bet gan var teikt, ka tie "izmanto tos kopā".
Jāatceras, ka ja elements zaudē elektronu, tad tā oksidēšanās pakāpe ir pozitīva, bet ja pieņem, tad negatīva.
Elementu, kurš zaudē elektronus, sauc par reducētāju. Reducētājs reakcijas gaitā oksidējās (paaugstina savu oksidēšanās pakāpi).
Elementu, kurš pieņem elektronus, sauc par oksidētāju. Oksidētājs reakcijas gaitā reducējās (pazemina oksidēšanās pakāpi).
Skābeklis ir viens no dabā visplašāk sastopamajiem oksidētājiem. Tas reakcijās pievieno 4 elektronus un savienojumos veido oksidēšanās pakāpi +2 (jo sastāv no 2 skābekļa atomiem un katrs no skābekļa atomiem pievieno 2 elektronus). Piemēram, dedzinot ogles grilā notiek šāda reakcija:
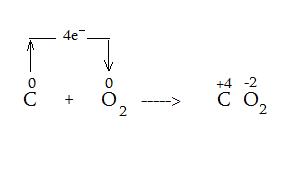
Oksidēšanās procesi ir plaši izplatīti dabā, kā piemēru var minēt metālu koroziju (dzelzs rūsēšana), trūdēšana (kūdras veidošanās), atkritumu sadalīšanās (dabas produkti sadaloties veido metānu) - šie procesi ir lēni, bet tādi procesi kā degšana gaisā (ogļu, ūdeņraža, naftas utt.) ir ātrs oksidēšanās process, kurā viela izreaģē ar gaisā esošo skābekli (skābeklis pieņem elektronus šajos procesos, tāpēc tas ir oksidētājs).
Ūdeņradis ir bioloģiski nekaitīgs kurināmais (degviela), jo tā degšanas rezultātā rodas ūdens: