Ūdens šķīdumos elektrolīti sadalās pozitīvos jonos katjonos un negatīvos jonos anjonos. Neelektrolīti jonos nesadalās, un parasti tās ir ūdenī nešķīstošas vielas, gāzveida vielas, daudzas organiskas vielas. Jonos praktiski nesadalās arī ūdens molekulas.
Divu elektrolītu šķīdumos var sākties mijiedarbība starp šķīdumā esošajiem joniem. Uzskata, ka jonu reakcijas notiek līdz galam tad, ja reakcijas gaitā kādi joni no reakcijas vides tiek aizvadīti. Tas var notikt, ja reakcijas rezultātā rodas nešķīstošs, mazdisociēts vai arī gaistošs savienojums.
Ķīmiskā savienojuma šķīdību ūdenī var noteikt, izmantojot vielu šķīdības tabulu. Tabulā esošie apzīmējumi norāda, kurš savienojums ir nešķīstošs (nogulsnes).
Mazdisociētas vielas ir vājie elektrolīti, tātad vielas, kuru disociācijas pakāpe ir mazāka par 5 %. Piemēram, ūdens, etiķskābe u. c.
Gaistošas vielas ir gāzveida vielas, kas izdalās no ūdens šķīdumiem reakcijas gaitā. Piemēram, oglekļa dioksīds, sēra dioksīds, sērūdeņradis.
Jonu apmaiņas reakcijas būtību var attēlot ar jonu reakcijas saīsināto vienādojumu. Tajā parāda reaģējošos jonus un reakcijas produktu. Vielas satur gan reaģējošos jonus, gan arī tiem pretēji lādētus jonus jeb pretjonus, kuri reakcijā nepiedalās. Reakcijas jonu vienādojumā tiek rakstīti gan joni, kuri reakcijā piedalās, gan pretjoni, parādot vielas, kas jāņem, lai noritētu jonu apmaiņas reakcija.
Svarīgi!
Reakcijas jonu vienādojumos abās pusēs jābūt vienādam katra elementa atomu kopējam skaitam un elektrisko lādiņu algebriskajai summai.
Rakstot reakciju jonu vienādojumus, rīkojas šādi:
- elektrolītus, kas piedalās reakcijā, raksta jonu formā,
- praktiski nešķīstošās, mazdisociējošas un gaistošas vielas reakcijas vienādojumā raksta molekulārā formā,
- no ķīmiskā vienādojuma kreisās un labās puses izslēdz jonus, kuri reakcijas gaitā nemainās, un iegūst saīsināto jonu vienādojumu.

Zinot nosacījumus, kad jonu apmaiņas reakcijas notiks līdz galam, var prognozēt, kādos gadījumos notiks jonu apmaiņas reakcijas starp sāļiem un bāzēm; starp skābēm un sāļiem; starp diviem sāļiem.
Jonu apmaiņas reakcija starp sāli un bāzi
Notiek tad, ja abas izejvielas ir ūdenī šķīstošas, bet reakcijas rezultātā viens no reakcijas produktiem veido nogulsnes. Ir iespējamas arī reakcijas, kad abi reakcijas produkti ir nešķīstošas vielas.
Jonu apmaiņas reakcija starp skābi un sāli
Notiek, ja abas izejvielas ir ūdenī šķīstošas, bet reakcijas rezultātā viens no produktiem ir gaistoša viela vai veido nogulsnes.
Jonu apmaiņas reakcija starp diviem sāļiem
Notiek, ja abas izejvielas ir ūdenī šķīstošas, bet reakcijas rezultātā viens vai abi reakcijas produkti veido nogulsnes.
Saīsinātos jonu reakcijas vienādojumus var izmantot, lai plānotu eksperimentu kādas noteiktas vielas iegūšanai.
Piemērs:
Lai iegūtu nešķīstošu savienojumu , ir nepieciešami un joni. To mēs uzzināsim no saīsinātā jonu reakcijas vienādojuma , kas parāda, ka, savstarpēji saistoties cinka joniem un hidroksīdjoniem, veidojas cinka hidroksīds. Cinka joni veidojas, ja ūdenī izšķīdina cinka sāļus, bet hidroksīdjoni veidojas, ja ūdenī izšķīdina bāzes. Vielu šķīdības tabulā atrod šķīstošo cinka sāļu ķīmiskās formulas , , u. c. un ūdenī šķīstošo bāzu ķīmiskās formulas , u. c.
Salejot kopā jebkuru no atrastajiem cinka sāļu šķīdumiem ar jebkuru bāzes šķīdumu, jonu apmaiņas reakcijā veidosies cinka hidroksīds , kas izdalīsies baltu nogulšņu veidā.

Pēc tam, kad esam izvēlējušies reakcijas izejvielas, varam uzrakstīt arī molekulāro vienādojumu, piemēram:
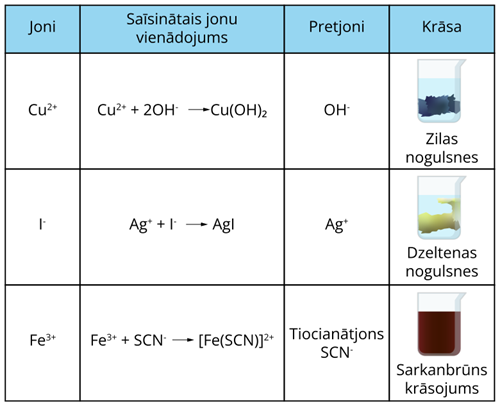
Daži joni ir bezkrāsaini, bet citiem ir raksturīga noteikta krāsa. Jonu krāsu izmanto kvalitatīvajā analīzē jonu pierādīšanai. Daudziem joniem var piemeklēt pretjonus, kurus ievadot šķīdumā iegūst raksturīgas nogulsnes vai krāsu. Analizējamo vielu izšķīdina ūdenī un pielej šķīdumu, kas satur meklējamā jona pretjonu. Ja reakcijas rezultātā iegūst vielu ar raksturīgu krāsu, tad var uzskatīt, ka analizējamais paraugs satur meklēto jonu.