Saistību starp daļiņām pēc stipruma var iedalīt vājā, vidēji stiprajā un stiprajā saistībā. Stiprā saistība starp vielas daļiņām tiek saukta par ķīmisko saiti. Ķīmiskā saite būtībā ir mijiedarbība starp atsevišķu atomu elektroniem. Ķīmiskā saite veidojas starp diviem atomiem, kuriem ārējā enerģijas līmenī ir vismaz viens nesapārots elektrons un šo elektronu spini ir pretēji vērsti. Nesapārotajiem elektroniem apvienojoties, diviem atomu kodoliem rodas kopīgs elektronu pāris, kas paliek kopīgajā orbitālē, ko pieņemts saukt par molekulāro orbitāli. Var uzskatīt, ka molekulārā orbitāle veidojas, daļēji pārklājoties atomārajām orbitālēm.
Kovalentā saite
Ja starp diviem atomiem izveidojas kopīgs elektronu pāris, kurš vienlaicīgi pieder diviem kodoliem, tad saka, ka veidojas kovalentā saite.
Ķīmisko saiti, kuru veido divu atomu kopīgs elektronu pāris sauc par kovalento saiti.
Ja kovalentā saite jeb kopīgais elektronu pāris veidojas starp divu atšķirīgu ķīmisko elementu atomiem, tad elektronu mākoņa sablīvējums novirzās uz viena vai otra atoma kodola pusi, šādā gadījumā ir izveidojusies polārā kovalentā saite.
Viens no atomiem ir ieguvis noteiktu negatīvā lādiņa daļu , bet otrs tieši tādu pašu daļu zaudējis, tātad ieguvis pozitīvā lādiņa daļu . Šādās molekulās izveidojas dipols. Polārā kovalentā saite vērojama molekulās, kas veidojas starp atšķirīgiem atomiem, piemēram, u.c.
Kovalento saišu attēlošanai molekulās izmanto molekulu elektronformulas un struktūrformulas, kurās shematiski tiek norādīts kopējais elektronu pāris. Molekulu elektronformulās attēlo tikai ārējā līmeņa elektronus.
Jonu saite
Ja ķīmiskās saites kopīgo elektronu pāri viens no atomu kodoliem pievelk daudz spēcīgāk un orbitāļu pārklāšanās apgabals atrodas gandrīz tikai viena atoma telpā, tad veidojas pretēji lādēti joni. Mijiedarbību starp šiem pretēji lādētiem joniem sauc par jonu saiti. Jonu saite veidojas starp metālu un nemetālu atomiem, piemēram, kalcija oksīdā CaO, nātrija hlorīdā NaCl u.c.
Svarīgi!
Jonu saiti starp pozitīvajiem un negatīvajiem joniem realizē elektrostatiskie pievilkšanās spēki.
Par elementa atoma spēju piesaistīt elektronu var spriest, izmērot jonizācijas enerģiju un elektrontieksmes enerģiju.
Jonizācijas enerģija ir tā enerģija, kas jāpatērē, lai no atoma atrautu vienu elektronu.
Elektrontieksmes enerģija ir tā enerģija, kas atbrīvojas, kad atoms pievieno vienu elektronu.
Elektronegativitāte, ko apzīmē ar EN, ir abu šo enerģiju vidējais lielums. Elektronegativitāte raksturo atoma spēju pavirzīt uz savu pusi ķīmiskās saites elektronus.
Elektronegativitāti var aprēķināt kā atoma elektrontieksmes un jonizācijas enerģijas pussummu.
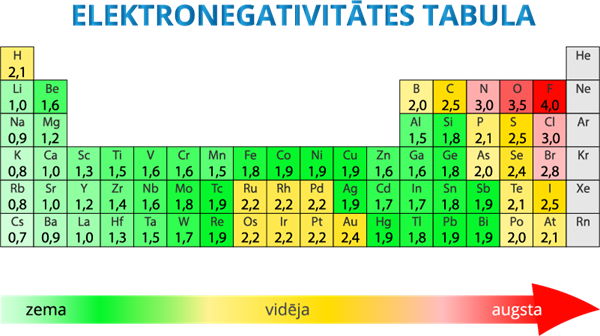
Lai elektronegativitātes skaitliskais lielums būtu ērti izmantojams aprēķinos, izmanto relatīvās elektronegativitātes REN skalu. Šādi iegūtās relatīvās elektronegativitātes ir apkopotas tabulā, un tās izmanto saites polaritātes raksturošanai.
Kad starp diviem atomiem izveidojas ķīmiskā saite, tad starp kodoliem atrodas saites elektronu mākoņa sablīvējums. Var uzskatīt, ka atomi viens ar otru konkurē, lai šo elektronu mākoņa sablīvējumu nobīdītu uz savu pusi. Šajā konkurencē "uzvar" tas atoms, kam piemīt lielāka elektronegativitāte. Saites elektronu mākoņa sablīvējums novirzās uz šī atoma pusi un saite kļūst polāra. Elektronegatīvākais atoms ir ieguvis negatīvu daļlādiņu, līdz ar to otrs atoms ir ieguvis pozitīvu daļlādiņu.
Starp polāro kovalento saiti un jonu saiti nav krasas robežas. Izrādās, ka polāriem kovalentiem savienojumiem sāk izpausties jonu savienojumu īpašības, ja to relatīvo elektronegativitāšu starpība REN ir robežās no 1 līdz 3,4.

Piemērs:
Fluora un litija REN = 3,0, jo ren F ir 4,0, bet REN Li ir 1,0, tātad izmantojot tabulā dotos datus, var izdarīt secinājumu, ka pēc ķīmiskās saites dabas šī saite Li-F klasificējama kā jonu saite.
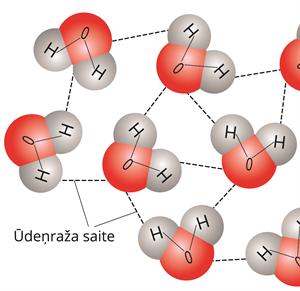
Ūdeņraža saite
Ūdeņraža saite ir vidēji stiprā mijiedarbība starp molekulām. Ūdeņraža saite veidojas starp molekulām, kurās ūdeņradis ir kovalenti saistīts ar kādu ķīmisko elementu, kuram ir liela elektronegativitāte REN, visbiežāk tas ir fluors, skābeklis vai slāpeklis. Piemēram, ūdeņraža saite veidojas starp ūdens molekulām, fluorūdeņražskābes HF molekulām, starp daudzu organisko vielu molekulām.
Lai gan ūdeņraža saite, kas darbojas starp molekulām, ir aptuveni desmit reižu vājāka par jebkuru ķīmisko saiti, kas darbojas molekulā, šīs saites jūtami ietekmē vielu īpašības. Piemēram, viršanas temperatūra vielām, starp kuru molekulām pastāv ūdeņraža saites, ir augstākas.